Ketonaj korpoj estas kreitaj de la hepato kaj uzataj kiel energifonto kiam glukozo ne estas facile havebla en la homa korpo. La du ĉefaj ketonkorpoj estas acetoacetato (AcAc) kaj 3-beta-hidroksibutirato (3HB), dum acetono estas la tria kaj malplej abunda, ketonkorpo. Ketonoj ĉiam ĉeestas en la sango kaj iliaj niveloj pliiĝas dum fastado kaj longedaŭra ekzercado. Ketogenezo estas la biokemia procezo per kiu organismoj produktas ketonajn korpojn per disrompo de grasacidoj kaj ketogenaj aminoacidoj.
Ketonaj korpoj estas ĉefe generitaj en la mitokondrioj de hepataj ĉeloj. Ketogenezo okazas kiam estas malaltaj glukozoniveloj en la sango, precipe post kiam aliaj ĉelaj karbonhidrataj butikoj, kiel ekzemple glikogeno, estis elĉerpitaj. Ĉi tiu mekanismo ankaŭ povas okazi kiam estas nesufiĉaj kvantoj de insulino. La produktado de ketonaj korpoj estas finfine komencita por disponigi energion, kiu estas stokita en la homa korpo kiel grasacidoj. Ketogenezo okazas en la mitokondrioj kie ĝi estas sendepende reguligita.
Enhavtabelo
abstrakta
Ketonkorpa metabolo estas centra nodo en fiziologia homeostazo. En ĉi tiu revizio, ni diskutas kiel ketonoj servas diskretajn fajn-agordantajn metabolajn rolojn, kiuj optimumigas organon kaj organismon en diversaj nutraj restaĵoj kaj protektas kontraŭ inflamo kaj vundo en multoblaj organsistemoj. Tradicie rigardataj kiel metabolaj substratoj rekrutitaj nur en karbonhidrata limigo, lastatempaj observaĵoj substrekas la gravecon de ketonaj korpoj kiel esencaj metabolaj kaj signalaj mediaciistoj kiam karbonhidratoj estas abundaj. Komplementante repertuaron de konataj terapiaj opcioj por malsanoj de la nerva sistemo, ekestis eventualaj roloj por ketonaj korpoj en kancero, same kiel interesaj protektaj roloj en koro kaj hepato, malfermante terapiajn opciojn en obesidad-rilata kaj kardiovaskula malsano. Konfliktoj en ketonmetabolo kaj signalado estas diskutitaj por akordigi klasikan dogmon kun nuntempaj observaĵoj.
Enkonduko
Ketonaj korpoj estas esenca alternativa metabola fuelfonto por ĉiuj domajnoj de vivo, eŭkarioj, bakterioj kaj arkeoj (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). Ketonkorpa metabolo en homoj estis ekspluatita por nutri la cerbon dum epizodaj periodoj de nutra senigo. Ketonkorpoj estas interplektitaj kun decidaj mamulaj metabolaj padoj kiel ekzemple ?-oksigenado (FAO), la trikarboksilacida ciklo (TCA), glukoneogenezo, de novo lipogenezo (DNL), kaj biosintezo de steroloj. En mamuloj, ketonkorpoj estas produktitaj ĉefe en la hepato de FAO-derivita acetil-CoA, kaj ili estas transportitaj al eksterhepataj histoj por fina oksigenado. Tiu fiziologio disponigas alternativan fuelon kiu estas pliigita per relative mallongaj periodoj de fastado, kiu pliigas grasacidan haveblecon kaj malpliigas karbonhidrathaveblecon (Cahill GF Jr, 2006; McGarry kaj Foster, 1980; Robinson kaj Williamson, 1980). Oksigenado de cetona korpo fariĝas signifa kontribuanto al totala energia mamula metabolo ene de eksterhepataj histoj en miriado de fiziologiaj statoj, inkluzive de fastado, malsato, la novnaska periodo, post-ekzerco, gravedeco, kaj aliĝo al malaltaj karbonhidrataj dietoj. Cirkulantaj totalaj ketonkorpaj koncentriĝoj en sanaj plenkreskaj homoj normale elmontras taĉmentajn osciladojn inter ĉirkaŭ 100-250 µM, pliiĝas al ~1 mM post longedaŭra ekzercado aŭ 24 h da fastado, kaj povas akumuliĝi ĝis 20 mM en patologiaj statoj kiel diabeta ketoacidozo (Cahill). GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson kaj Williamson, 1980; Wildenhoff et al., 1974). La homa hepato produktas ĝis 300 g da ketonaj korpoj tage (Balasse kaj Fery, 1989), kiuj kontribuas inter 5-20% de totala energi-elspezo en nutrataj, fastantaj kaj malsataj ŝtatoj (Balasse et al., 1978; Cox et al. al., 2016).
Lastatempaj studoj nun elstarigas neprajn rolojn por ketonkorpoj en mamula ĉelmetabolo, homeostazo, kaj signalado sub vasta gamo de fiziologiaj kaj patologiaj statoj. Krom funkcii kiel energiaj brulaĵoj por eksterhepataj histoj kiel cerbo, koro aŭ skeletmuskolo, ketonaj korpoj ludas pivotajn rolojn kiel signalaj mediaciistoj, ŝoforoj de proteina post-traduka modifo (PTM), kaj modulatoroj de inflamo kaj oksidativa streso. En ĉi tiu revizio, ni provizas kaj klasikajn kaj modernajn vidojn pri la pleiotropikaj roloj de ketonaj korpoj kaj ilia metabolo.
Superrigardo de Ketona Korpa Metabolo
La indico de hepata ketogenezo estas regita per reĝisorita serio de fiziologiaj kaj biokemiaj transformoj de graso. Primaraj reguligistoj inkludas lipolizon de grasacidoj de triacilgliceroloj, transporton al kaj trans la hepatocita plasmomembrano, transporton en mitokondriojn per karnitina palmitoiltransferazo 1 (CPT1), la ?-oksididan spiralon, TCA-ciklo-agadon kaj mezajn koncentriĝojn, redox-potencialon, kaj la hormonajn reguligistojn. de ĉi tiuj procezoj, ĉefe glukagono kaj insulino [reviziita en (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry kaj Foster; , 1980; Williamson et al., 1969)]. Klasike ketogenezo estas rigardita kiel transflua pado, en kiu ?-oksidiĝ-derivita acetil-CoA superas citratsintezaktivecon kaj/aŭ oksalacetathaveblecon por kondensado por formi citraton. Tri-karbonaj intermediatoj elmontras kontraŭ-ketogenan agadon, supozeble pro sia kapablo vastigi la oksalacetatnaĝejon por acetil-CoA-konsumo, sed hepata acetil-CoA koncentriĝo sole ne determinas ketogenan indicon (Foster, 1967; Rawat kaj Menahan, 1975; Williamson). et al., 1969). La reguligo de ketogenezo per hormonaj, transskribaj kaj post-tradukaj eventoj kune subtenas la nocion, ke la molekulaj mekanismoj, kiuj fajnagordas ketogenan indicon, restas nekomplete komprenitaj (vidu Reguligon de HMGCS2 kaj SCOT/OXCT1).
Ketogenezo okazas ĉefe en hepata mitokondria matrico kun rapidecoj proporciaj al totala grasoksigenado. Post transporto de acil-ĉenoj trans la mitokondriaj membranoj kaj ?-oksigenado, la mitokondria izoformo de 3-hidroksimetilglutaryl-CoA sintazo (HMGCS2) katalizas la sorton farante kondensadon de acetoacetil-CoA (AcAc-CoA) kaj acetil-CoA por generi HMG-CoA. (Fig. 1A). HMG-CoA liazo (HMGCL) fendas HMG-CoA por liberigi acetil-CoA kaj acetoacetaton (AcAc), kaj ĉi-lasta estas reduktita al d-?-hidroksibutirato (d-?OHB) per fosfatidilkolin-dependa mitokondria d-?OHB dehidrogenazo ( BDH1) en NAD+/NADH-kunligita preskaŭ-ekvilibra reago (Bock kaj Fleischer, 1975; LEHNINGER et al., 1960). La BDH1-ekvilibra konstanto favoras d-?OHB-produktadon, sed la rilatumo de AcAc/d-?OHB ketonkorpoj estas rekte proporcia al mitokondria NAD+/NADH-proporcio, kaj tiel BDH1-oksidoreductase-agado modulas mitokondrian redox-potencialon (Krebs et al., 1969; Williamson et al., 1967). AcAc ankaŭ povas spontanee decarboxylate al acetono (Pedersen, 1929), la fonto de dolĉa odoro en homoj suferantaj ketoacidozon (t.e., totalaj serumaj ketonkorpoj> ~7 mM; AcAc pKa 3.6, ?OHB pKa 4.7). La mekanismoj tra kiuj ketonkorpoj estas transportitaj trans la mitokondrian internan membranon ne estas konataj, sed AcAc/d-?OHB estas liberigitaj de ĉeloj per monokarboksilitaj transportiloj (en mamuloj, MCT 1 kaj 2, ankaŭ konataj kiel solutportisto 16A familianoj 1 kaj 7) kaj transportitaj en la cirkulado al eksterhepataj histoj por fina oksigenado (Cotter et al., 2011; Halestrap kaj Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Koncentriĝoj de cirkulantaj ketonkorpoj estas pli altaj ol tiuj en la eksterhepataj histoj (Harrison kaj Long, 1940) indikante ketonkorpojn estas transportitaj laŭ koncentriĝgradiento. Perdo-de-funkciaj mutacioj en MCT1 estas rilataj al spontaneaj atakoj de ketoacidozo, sugestante kritikan rolon en ketonkorpimportado.
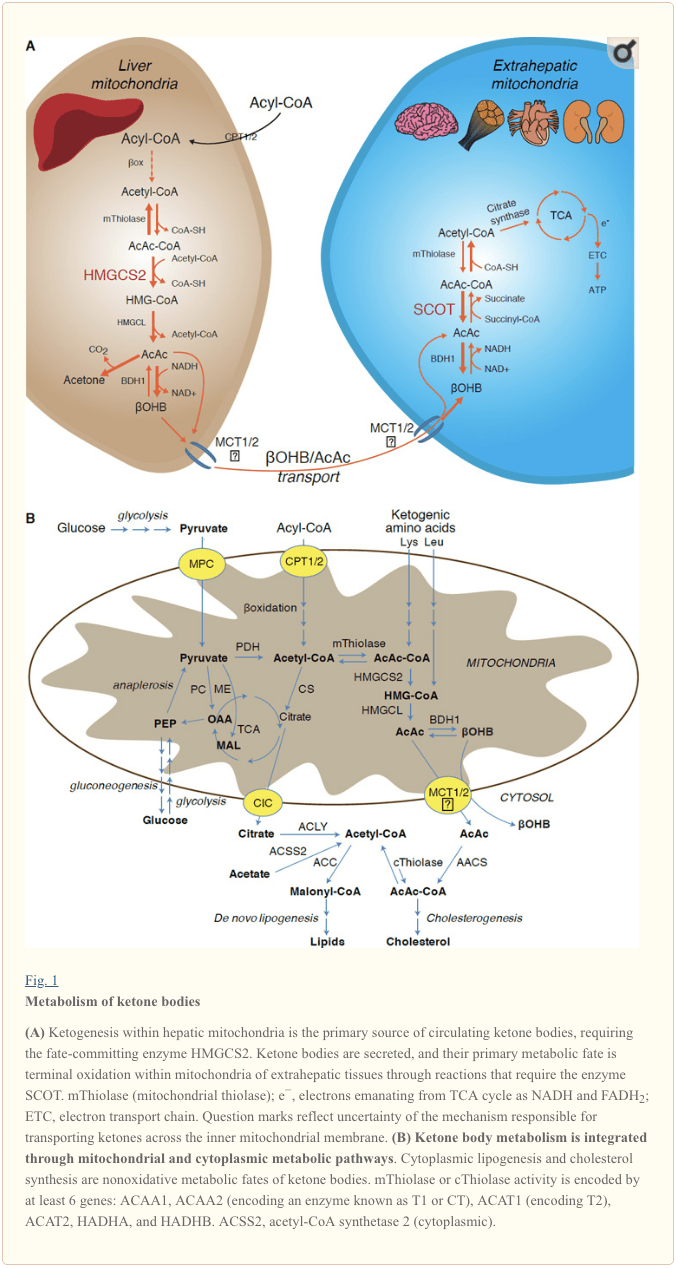
Kun la escepto de ebla distraĵo de ketonkorpoj en ne-oksidativaj sortoj (vidu Ne-oksidativaj metabolaj sortoj de ketonkorpoj), al hepatocitoj mankas la kapablo metaboligi la ketonkorpojn kiujn ili produktas. Ketonkorpoj sintezitaj de novo per hepato estas (i) katabolizitaj en mitokondrioj de eksterhepataj histoj al acetil-CoA, kiu estas havebla al la TCA-ciklo por fina oksigenado (Fig. 1A), (ii) deturnitaj al la lipogenezo aŭ sterol-sintezaj vojoj ( Fig. 1B), aŭ (iii) sekreciita en la urino. Kiel alternativa energia fuelo, ketonaj korpoj estas fervore oksigenitaj en koro, skeletmuskolo kaj cerbo (Balasse kaj Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan, 1988). ). Eksterhepata mitokondria BDH1 katalizas la unuan reagon de ?OHB-oksidado, konvertante ĝin al reen AcAc (LEHNINGER et al., 1960; Sandermann et al., 1986). Citoplasma d-?OHB-dehidrogenazo (BDH2) kun nur 20% sekvencidenteco al BDH1 havas altan Km por ketonkorpoj, kaj ankaŭ ludas rolon en ferhomeostazo (Davuluri et al., 2016; Guo et al., 2006) . En eksterhepata mitokondria matrico, AcAc estas aktivigita al AcAc-CoA tra interŝanĝo de CoA-parto de succinyl-CoA en reago katalizita per unika mamula CoA transferazo, succinyl-CoA:3-oxoacid-CoA transferazo (SCOT, CoA transferazo); ĉifrite fare de OXCT1), tra proksima ekvilibra reago. La libera energio liberigita per hidrolizo de AcAc-CoA estas pli bonega ol tiu de succinyl-CoA, preferante AcAc-formacion. Tiel ketonkorpa oksidativa fluo okazas pro amasa ago: abunda liverado de AcAc kaj rapida konsumo de acetil-CoA tra cittratsintezazo favoras AcAc-CoA (+ sucinato) formadon de SCOT. Precipe, kontraste al glukozo (heksokinazo) kaj grasacidoj (acyl-CoA-sintetazoj), la aktivigo de ketonkorpoj (SCOT) en oksideblan formon ne postulas la investon de ATP. Reigebla AcAc-CoA tiolaza reago [katalizita per iu ajn el la kvar mitokondriaj tiolazoj ĉifritaj per aŭ ACAA2 (ĉifrante enzimon konatan kiel T1 aŭ CT), ACAT1 (ĉifrante T2), HADHA, aŭ HADHB] donas du molekulojn de acetil-CoA, kiuj eniras la TCA-ciklon (Hersh kaj Jencks, 1967; Stern et al., 1956; Williamson et al., 1971). Dum ketozaj statoj (t.e., totalaj serukaj ketonoj > 500 µM), ketonaj korpoj iĝas signifaj kontribuantoj al energielspezo kaj estas uzataj en histoj rapide ĝis konsumado aŭ saturiĝo de oksigenado okazas (Balasse et al., 1978; Balasse kaj Fery, 1989; Edmond). et al., 1987). Tre malgranda frakcio de hepat-derivitaj ketonkorpoj povas esti facile mezurita en la urino, kaj utiligo kaj resorbadaj indicoj de la reno estas proporciaj al cirkulanta koncentriĝo (Goldstein, 1987; Robinson kaj Williamson, 1980). Dum tre ketozaj statoj (> 1 mM en plasmo), ketonurio funkcias kiel duonkvanta raportisto de ketozo, kvankam la plej multaj klinikaj provoj de urina ketonkorpoj detektas AcAc sed ne ?OHB (Klocker et al., 2013).
Ketogenaj Substratoj kaj ilia Efiko sur Hepatocita Metabolo
Ketogenaj substratoj inkluzivas grasajn acidojn kaj aminoacidojn (Fig. 1B). La katabolismo de aminoacidoj, precipe leŭcino, generas proksimume 4% de ketonkorpoj en post-sorba stato (Thomas et al., 1982). Tiel la acetil-CoA-substrato por generi ketonkorpojn plejparte venas de grasacidoj, ĉar dum statoj de malpliigita karbonhidratprovizo, piruvato eniras la hepatan TCA-ciklon ĉefe per anaplerozo, t.e., ATP-dependa karboksiligo al oksaloacetato (OAA), aŭ al malato. (MAL), kaj ne oksidativa dekarboxilado al acetil-CoA (Jeoung et al., 2012; Magnusson et al., 1991; Merritt et al., 2011). En hepato, glukozo kaj piruvato kontribuas neglekteble al ketogenezo, eĉ kiam piruvata dekarboksiliĝo al acetil-CoA estas maksimuma (Jeoung et al., 2012).
Acetil-CoA inkluzivas plurajn rolojn integritaj al hepata peranta metabolo preter ATP-generacio per fina oksigenado (ankaŭ vidu La integriĝon de ketonkorpa metabolo, post-traduka modifo, kaj ĉelfiziologio). Acetil-CoA alostere aktivigas (i) piruvatkarboxilazon (komputilo), tiel aktivigante metabolan kontrolmekanismon kiu pliigas anaplerozan eniron de metabolitoj en la TCA-ciklon (Owen et al., 2002; Scrutton and Utter, 1967) kaj (ii) piruvatdehidrogenazon. kinazo, kiu fosforilatas kaj malhelpas piruvatdehidrogenazon (PDH) (Cooper et al., 1975), tiel plue plifortigante fluon de piruvato en la TCA-ciklon per anaplerozo. Krome, citoplasma acetil-CoA, kies naĝejo estas pliigita per mekanismoj kiuj transformas mitokondrian acetil-CoA al transporteblaj metabolitoj, malhelpas grasacidajn oksidadon: acetil-CoA-karboxilazo (ACC) katalizas la konvertiĝon de acetil-CoA al malonil-CoA, la lipogena substrato. kaj alostera inhibitoro de mitokondria CPT1 [reviziita en (Kahn et al., 2005; McGarry kaj Foster, 1980)]. Tiel, la mitokondria acetil-CoA naĝejo kaj reguligas kaj estas reguligita per la disverŝa vojo de ketogenezo, kiu reĝisoras ŝlosilajn aspektojn de hepata peranta metabolo.
Ne-Oksidativaj Metabolaj Sortoj de Ketonaj Korpoj
La superrega sorto de hepat-derivitaj ketonoj estas SCOT-dependa eksterhepata oksigenado. Tamen, AcAc povas esti eksportita de mitokondrioj kaj utiligita en anabolaj vojoj per konvertiĝo al AcAc-CoA per ATP-dependa reago katalizita de citoplasma acetoacetil-CoA sintetazo (AACS, Fig. 1B). Ĉi tiu vojo estas aktiva dum cerba evoluo kaj en laktado de mama glando (Morris, 2005; Robinson kaj Williamson, 1978; Ohgami et al., 2003). AACS ankaŭ estas tre esprimita en adipoza histo, kaj aktivigitaj osteoklastoj (Aguilo et al., 2010; Yamasaki et al., 2016). Citoplasma AcAc-CoA povas esti aŭ direktita per citosola HMGCS1 direkte al sterolbiosintezo, aŭ fendita per ĉiu el ambaŭ de du citoplasmaj tiolazoj al acetil-CoA (ACAA1 kaj ACAT2), karboksilateita al malonil-CoA, kaj kontribui al la sintezo de grasacidoj (Bergstro-CoA). al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber kaj Edmond, 1977).
Dum la fiziologia signifo ankoraŭ estas establita, ketonoj povas funkcii kiel anabolaj substratoj eĉ en la hepato. En artefaritaj eksperimentaj kuntekstoj, AcAc povas kontribui al eĉ duono de lastatempe sintezita lipido, kaj ĝis 75% de nova sintezita kolesterolo (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). Ĉar AcAc estas derivita de nekompleta hepata grasoksigenado, la kapablo de AcAc kontribui al lipogenezo en vivo implicus hepatan vanan bicikladon, kie gras-derivitaj ketonoj povas esti utiligitaj por lipidproduktado, nocio kies fiziologia signifo postulas eksperimentan validumon, sed povus servi. adaptaj aŭ maladaptaj roloj (Solinas et al., 2015). AcAc fervore liveras kolesterogenezon, kun malalta AACS Km-AcAc (~50 µM) preferante AcAc-aktivigon eĉ en la manĝita ŝtato (Bergstrom et al., 1984). La dinamika rolo de citoplasma ketonmetabolo estis sugestita en primaraj musaj embriaj neŭronoj kaj en 3T3-L1 derivitaj adipocitoj, ĉar AACS-knockdown difektis diferencigon de ĉiu ĉeltipo (Hasegawa et al., 2012a; Hasegawa et al., 2012b). Frapo de AACS en musoj en vivo malpliigis seruman kolesterolon (Hasegawa et al., 2012c). SREBP-2, majstra transkripcia reguligisto de kolesterol-biosintezo, kaj peroksizoma proliferanto aktivigita receptoro (PPAR)-? estas AACS-transskribaj aktivigantoj, kaj reguligas ĝian transskribon dum neŭritevoluo kaj en la hepato (Aguilo et al., 2010; Hasegawa et al., 2012c). Kune, citoplasma ketonkorpa metabolo povas esti grava en elektitaj kondiĉoj aŭ malsana naturhistorio, sed estas neadekvata por forigi hepat-derivitajn ketonkorpojn, ĉar masiva hiperketonemia okazas en la medio de selektema kripliĝo de la primara oksidativa sorto per perdo de funkciomutacioj. al SCOT (Berry et al., 2001; Cotter et al., 2011).
Reguligo de HMGCS2 kaj SCOT/OXCT1
La diverĝo de mitokondrio de la geno kodanta citosolan HMGCS okazis frue en vertebrul-evoluo pro la bezono subteni hepatan ketogenezon en specioj kun pli altaj proporcioj de cerbo al korpopezo (Boukaftane et al., 1994; Cunnane kaj Crawford, 2003). Nature okazantaj perdo-de-funkciaj mutacioj de HMGCS2 en homoj kaŭzas atakojn de hipoketoza hipoglikemio (Pitt et al., 2015; Thompson et al., 1997). Fortika HMGCS2-esprimo estas limigita al hepatocitoj kaj kolonika epitelio, kaj ĝia esprimo kaj enzimeca agado estas kunordigitaj per diversaj mekanismoj (Mascaro et al., 1995; McGarry kaj Foster, 1980; Robinson kaj Williamson, 1980). Dum la plena amplekso de fiziologiaj statoj kiuj influas HMGCS2 postulas plian klarigon, ĝia esprimo kaj/aŭ agado estas reguligitaj dum la frua postnaska periodo, maljuniĝo, diabeto, malsato aŭ konsumado de ketogena dieto (Balasse kaj Fery, 1989; Cahill GF Jr, 2006). ; Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). En la feto, metiligo de 5' laŭflankanta regiono de Hmgcs2-geno inverse korelacias kun sia transskribo, kaj estas parte inversigita post naskiĝo (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; ., XNUMX). Simile, hepata Bdh1 elmontras evoluan esprimpadronon, pliiĝantan de naskiĝo ĝis dekutimiĝo, kaj ankaŭ estas induktita per ketogena dieto en fibroblasta kreskfaktoro (FGF) -21-dependa maniero (Badman et al., 2007; Zhang et al., 1989). ). Ketogenezo en mamuloj estas tre respondema al kaj insulino kaj glukagono, estante subpremita kaj stimulita, respektive (McGarry kaj Foster, 1977). Insulino subpremas grashiston lipolizon, tiel senigante ketogenezon de sia substrato, dum glukagono pliigas ketogenan fluon per rekta efiko al la hepato (Hegardt, 1999). Hmgcs2-transskribo estas stimulita per forkkapa transkripcifaktoro FOXA2, kiu estas inhibiciita per insulin-fosfatidilinositol-3-kinase/Akt, kaj estas induktita per glucagon-cAMP-p300 signalado (Arias et al., 1995; Hegardt, 1999; Quant et al. , 1990; Thumelin et al., 1993; von Meyenn et al., 2013; Wolfrum et al., 2004; Wolfrum et al., 2003). PPAR? (Rodriguez et al., 1994) kune kun ĝia celo, FGF21 (Badman et al., 2007) ankaŭ induktas Hmgcs2-transskribon en la hepato dum malsato aŭ administrado de ketogena dieto (Badman et al., 2007; Inagaki et al., 2007). ). Indukto de PPAR? povas okazi antaŭ la transiro de feta al novnaskita fiziologio, dum FGF21-aktivigo povas esti favorita en la frua novnaska periodo per ?OHB-mediata inhibicio de histondeacetilazo (HDAC)-3 (Rando et al., 2016). mTORC1 (mamula celo de rapamicin-komplekso 1) dependa inhibicio de PPAR? transskriba agado ankaŭ estas ŝlosila reguligisto de Hmgcs2-gen-esprimo (Sengupta et al., 2010), kaj hepato PER2, majstra cirkadia oscilatoro, nerekte reguligas Hmgcs2-esprimon (Chavan et al., 2016). Lastatempaj observaĵoj indikas ke eksterhepata tumor-induktita interleukin-6 difektas ketogenezon per PPAR? subpremado (Flint et al., 2016).
HMGCS2-enzimaktiveco estas reguligita tra multoblaj PTMoj. HMGCS2-serina fosforiligo plifortigis ĝian agadon en vitro (Grimsrud et al., 2012). HMGCS2-agado estas alostere inhibiciita de succinyl-CoA kaj lizina restaĵo succinilation (Arias et al., 1995; Hegardt, 1999; Lowe kaj Tubbs, 1985; Quant et al., 1990; Rardin et al., 2013; Reed et al. 1975; Thumelin et al., 1993). Succinylation de HMGCS2, HMGCL, kaj BDH1-lizinrestaĵoj en hepataj mitokondrioj estas celoj de la NAD+ dependa deacylase sirtuin 5 (SIRT5) (Rardin et al., 2013). HMGCS2-agado ankaŭ estas plifortigita per SIRT3-lizina deacetiligo, kaj estas eble ke interparolado inter acetilado kaj succinilation reguligas HMGCS2-agadon (Rardin et al., 2013; Shimazu et al., 2013). Malgraŭ la kapablo de ĉi tiuj PTMoj reguligi HMGCS2 Km kaj Vmax, fluktuoj de ĉi tiuj PTMoj ankoraŭ ne estis zorge mapitaj kaj ne estis konfirmitaj kiel mekanismaj ŝoforoj de ketogenezo en vivo.
SCOT estas esprimita en ĉiuj mamulaj ĉeloj kiuj enhavas mitokondriojn, krom tiuj de hepatocitoj. La graveco de SCOT-agado kaj ketolizo estis pruvita en SCOT-KO-musoj, kiuj elmontris unuforman letalecon pro hiperketonema hipoglikemio ene de 48h post naskiĝo (Cotter et al., 2011). Histo-specifa perdo de SCOT en neŭronoj aŭ skeletaj miocitoj induktas metabolajn anomaliojn dum malsato sed ne estas mortiga (Cotter et al., 2013b). En homoj, SCOT-manko prezentas frue en vivo kun severa ketoacidozo, kaŭzante letargion, vomadon kaj komaton (Berry et al., 2001; Fukao et al., 2000; Kassovska-Bratinova et al., 1996; Niezen-Koning et al., 1997. , 1987; Saudubray et al., 1998; Snyderman et al., 1972; Tildon kaj Cornblath, 1). Relative malmulto estas konata sur la ĉela nivelo pri SCOT-geno kaj proteinesprimreguligistoj. Oxct1974 mRNA-esprimo kaj SCOT-proteino kaj agado estas malpliigitaj en ketozaj statoj, eventuale per PPAR-dependaj mekanismoj (Fenselau kaj Wallis, 1976; Fenselau kaj Wallis, 1986; Grinblat et al., 1991; Okuda et al., 2001; Turko et al. ., 2010; Wentz et al., 1). En diabeta ketoacidozo, la misagordo inter hepata ketogenezo kaj eksterhepata oksigenado plimalboniĝas per difekto de SCOT-agado. Troesprimo de insulin-sendependa glukozotransportilo (GLUT2/SLC1A1) en kardiomiocitoj ankaŭ malhelpas Oxct2009-gen-esprimon kaj subreguligas ketonan fina oksidadon en ne-ketoza stato (Yan et al., 1). En hepato, Oxct122 mRNA-abundo estas subpremita per microRNA-3 kaj histonmetiligo H27K3me2011 kiuj estas evidentaj dum la transiro de feta al la novnaska periodo (Thorrez et al., 1). Tamen, subpremado de hepata Oxct1-esprimo en la postnaska periodo estas ĉefe atribuebla al la evakuado de Oxct1-esprimaj hematopoezaj prapatroj de la hepato, prefere ol perdo de antaŭe ekzistanta Oxct1-esprimo en fine diferencigitaj hepatocitoj. Fakte, esprimo de Oxct2008 mRNA kaj SCOT-proteino en diferencigitaj hepatocitoj estas ekstreme malalta (Orii et al., XNUMX).
SCOT ankaŭ estas reguligita per PTMoj. La enzimo estas hiper-acetilata en cerboj de SIRT3 KO musoj, kiuj ankaŭ elmontras malpliigitan AcAc-dependan acetil-CoA-produktadon (Dittenhafer-Reed et al., 2015). Ne-enzima nitrado de tirozinrestaĵoj de SCOT ankaŭ mildigas ĝian agadon, kiu estis raportita en koroj de diversaj diabetaj musmodeloj (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). En kontrasto, triptofan-restnitrado pliigas SCOT-agadon (Brégère et al., 2010; Rebrin et al., 2007). Molekulaj mekanismoj de rest-specifa nitrado aŭ malnitrado dizajnita por moduli SCOT-agadon povas ekzisti kaj postuli klarigon.
Konfliktoj en Eksterhepata Ketogenezo
En mamuloj la primara ketogena organo estas hepato, kaj nur hepatocitoj kaj intestaj epiteliĉeloj abunde esprimas la mitokondrian izoformon de HMGCS2 (Cotter et al., 2013a; Cotter et al., 2014; McGarry kaj Foster, 1980; Robinson kaj Williamson, 1980) . Malaeroba bakteria fermentado de kompleksaj polisakaridoj donas butiraton, kiu estas sorbita de kolonocitoj en mamuloj por fina oksigenado aŭ ketogenezo (Cherbuy et al., 1995), kiu povas ludi rolon en kolonocita diferencigo (Wang et al., 2016). Ekskludante intestajn epiteliajn ĉelojn kaj hepatocitojn, HMGCS2 estas preskaŭ forestanta en preskaŭ ĉiuj aliaj mamulaj ĉeloj, sed la perspektivo de eksterhepata ketogenezo estis levita en tumorĉeloj, astrocitoj de la centra nervosistemo, la reno, pankreata? ĉeloj, retina pigmentepitelio (RPE), kaj eĉ en skeletmuskolo (Adijanto et al., 2014; Avogaro et al., 1992; El Azzouny et al., 2016; Grabacka et al., 2016; Kang et al., 2015; ; Le Foll et al., 2014; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2016; Zhang et al., 2011). Ektopa HMGCS2 estis observita en histoj al kiuj mankas neta ketogena kapacito (Cook et al., 2016; Wentz et al., 2010), kaj HMGCS2 elmontras eventualajn ketogenez-sendependajn "lunlumajn" agadojn, inkluzive ene de la ĉelkerno (Chen et al. , 2016; Kostiuk et al., 2010; Meertens et al., 1998).
Ajna eksterhepata histo kiu oksigas ketonajn korpojn ankaŭ havas la eblon amasigi ketonajn korpojn per HMGCS2 sendependaj mekanismoj (Fig. 2A). Tamen, ekzistas neniu eksterhepata histo en kiu stabilŝtata ketonkorpa koncentriĝo superas tiun en la cirkulado (Cotter et al., 2011; Cotter et al., 2013b; Harrison kaj Long, 1940), substrekante ke ketonkorpoj estas transportitaj laŭlonge. koncentriĝa gradiento per MCT1/2-dependaj mekanismoj. Unu mekanismo de ŝajna eksterhepata ketogenezo povas fakte reflekti relativan difekton de ketonoksidado. Pliaj eblaj klarigoj falas en la sfero de ketonkorpa formado. Unue, de novo ketogenezo povas okazi per reigebla enzima agado de tiolazo kaj SCOT (Weidemann kaj Krebs, 1969). Kiam la koncentriĝo de acetil-CoA estas relative alta, reagoj normale respondecaj por AcAc-oksigenado funkcias en la inversa direkto (GOLDMAN, 1954). Dua mekanismo okazas kiam ?-oksidiĝ-derivigitaj intermediatoj akumuliĝas pro TCA-cikloprotlemkolo, AcAc-CoA estas konvertita al l-?OHB-CoA tra reago katalizita per mitokondria 3-hidroksiacyl-CoA dehidrogenazo, kaj plu de 3-hidroksibutyryl. CoA-deacilazo al l-?OHB, kiu estas nedistingebla per mas-spektrometrio aŭ resonanca spektroskopio de la fiziologia enantiomero d-?OHB (Reed kaj Ozand, 1980). l-?OHB povas esti kromatografie aŭ enzime distingita de d-?OHB, kaj ĉeestas en eksterhepataj histoj, sed ne en hepato aŭ sango (Hsu et al., 2011). Hepata ketogenezo produktas nur d-?OHB, la nuran enantiomeron kiu estas BDH-substrato (Ito et al., 1984; Lincoln et al., 1987; Reed kaj Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). Tria HMGCS2-sendependa mekanismo generas d-?OHB tra aminoacida katabolo, precipe tiu de leŭcino kaj lizino. Kvara mekanismo estas nur ŝajna ĉar ĝi ŝuldiĝas al etikedartefakto kaj estas tiel nomita pseŭdoketogenezo. Ĉi tiu fenomeno estas atribuebla al la reigebleco de la SCOT kaj tiolazaj reagoj, kaj povas kaŭzi supertakson de ketonkorpa spezo pro la izotopa diluo de ketonkorpspurilo en eksterhepata histo (Des Rosiers et al., 1990; Fink et al., 1988) . Tamen, pseŭdoketogenezo povas esti nekonsiderinda en la plej multaj kuntekstoj (Bailey et al., 1990; Keller et al., 1978). Skemo (Fig. 2A) indikas utilan aliron por apliki dum oni konsideras altigitan histan stabilan koncentriĝon de ketonoj.
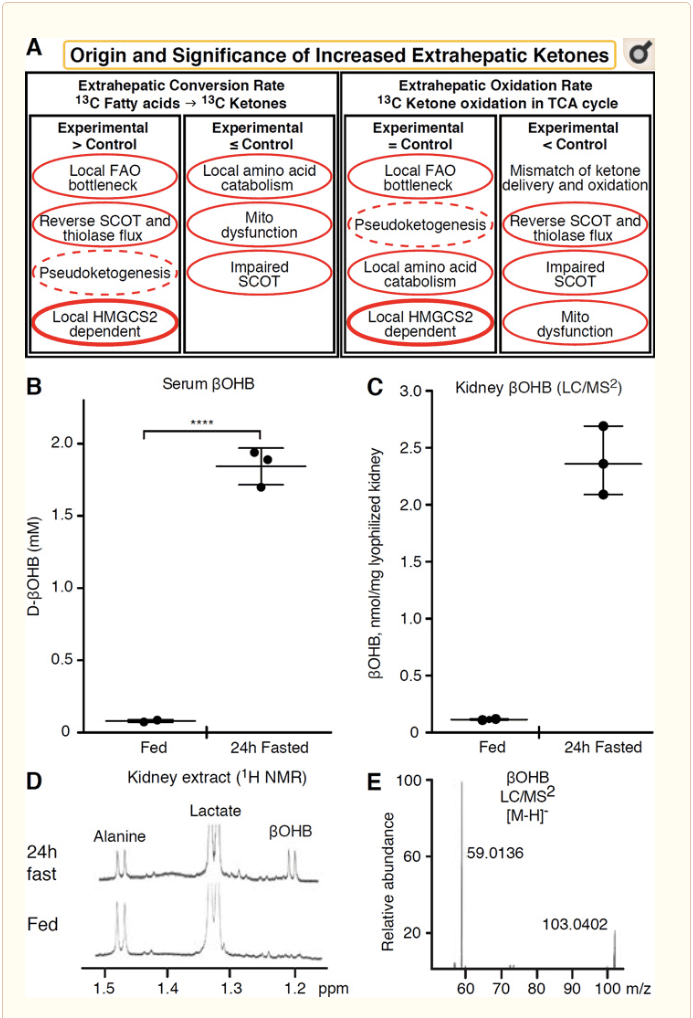

Reno ĵus ricevis atenton kiel eble ketogena organo. En la granda plimulto de ŝtatoj, la reno estas neta konsumanto de hepat-derivitaj ketonkorpoj, sekreciantaj aŭ reabsorbantajn ketonkorpojn de la sangocirkulado, kaj reno ĝenerale ne estas neta cetona korpogeneratoro aŭ koncentrilo (Robinson kaj Williamson, 1980). La verkintoj de klasika studo finis ke minimuma rena ketogenezo kvantigita en artefarita eksperimenta sistemo ne estis fiziologie signifa (Weidemann kaj Krebs, 1969). Lastatempe, rena ketogenezo estis konkludita en diabetaj kaj aŭtofagiaj mankhavaj musmodeloj, sed estas pli verŝajne ke multi-organaj ŝanĝoj en metabola homeostazo ŝanĝas integran ketonmetabolon per enigaĵoj sur multoblaj organoj (Takagi et al., 2016a; Takagi et al., 2016b; Zhang et al., 2011). Unu lastatempa publikigo sugestis rena ketogenezo kiel protekta mekanismo kontraŭ iskemio-reperfuza vundo en la reno (Tran et al., 2016). Absolutaj konstantaj koncentriĝoj de ?OHB el ekstraktoj de musoj rena histo estis raportitaj je ~4-12 mM. Por provi ĉu tio estis tenebla, ni kvantigis ?OHB-koncentriĝojn en renaj eltiraĵoj de nutritaj kaj 24h fastitaj musoj. Serumaj ?OHB-koncentriĝoj pliiĝis de ~100 µM ĝis 2 mM kun 24h fastado (Fig. 2B), dum renaj stabilŝtataj ?OHB-koncentriĝoj proksimiĝas 100 µM en la nutrita stato, kaj nur 1 mM en la 24h fasta ŝtato (Fig. 2C-). E), observaĵoj kiuj estas kongruaj kun koncentriĝoj kvantigitaj antaŭ pli ol 45 jaroj (Hems kaj Brosnan, 1970). Restas eble ke en ketozaj statoj, hepat-derivitaj ketonkorpoj povus esti renoprotektaj, sed indico por rena ketogenezo postulas plian pruvon. Konvinka indico kiu subtenas veran eksterhepatan ketogenezon estis prezentita en RPE (Adijanto et al., 2014). Ĉi tiu interesa metabola transformo estis sugestita por eble permesi al RPE-derivitaj ketonoj flui al fotoreceptoraj aŭ Müller-gliaj ĉeloj, kiuj povus helpi en la regenerado de fotoreceptora ekstera segmento.
?OHB kiel Signala Mediatoro
Kvankam ili estas energie riĉaj, ketonaj korpoj praktikas provokemajn "ne-kanonajn" signalajn rolojn en ĉela homeostazo (Fig. 3) (Newman kaj Verdin, 2014; Rojas-Morales et al., 2016). Ekzemple, ?OHB malhelpas Klaso I HDAC-ojn, kiu pliigas histon-acetiladon kaj tiel induktas la esprimon de genoj kiuj limigas oksidativan streson (Shimazu et al., 2013). ?OHB mem estas histona kovalenta modifilo ĉe lizinrestaĵoj en hepatoj de fastitaj aŭ streptozotocin induktitaj diabetaj musoj (Xie et al., 2016) (vidu ankaŭ malsupre, La integriĝo de ketonkorpa metabolo, post-traduka modifo kaj ĉela fiziologio, kaj Ketonaj korpoj, oksidativa streso kaj neŭroprotekto).
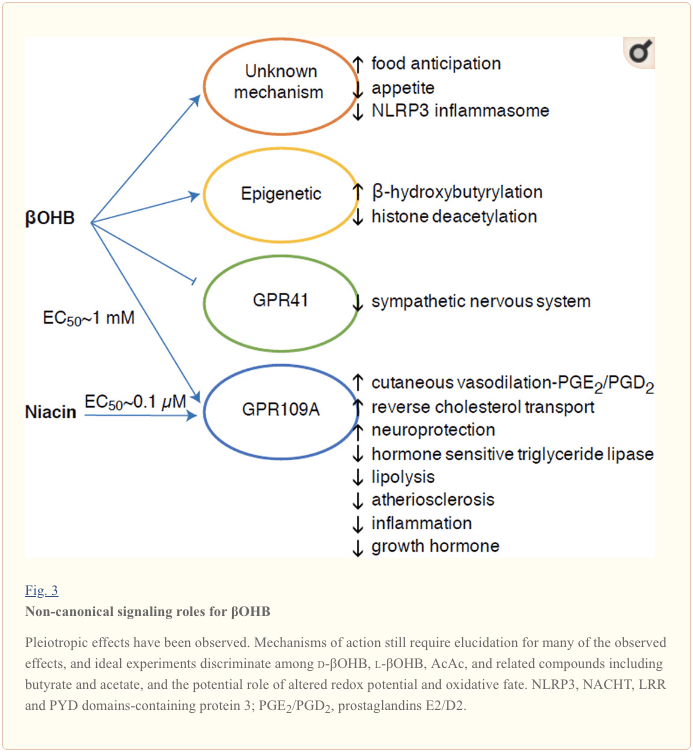
?OHB ankaŭ estas efektulo per G-proteinaj kunligitaj receptoroj. Per neklaraj molekulaj mekanismoj, ĝi subpremas agadon de la simpatia nerva sistemo kaj reduktas totalan energispezon kaj korfrekvencon malhelpante mallongan ĉenan grasacidan signaladon per G-proteino kunligita ricevilo 41 (GPR41) (Kimura et al., 2011). Unu el la plej studitaj signalefikoj de ?OHB-enspezo tra GPR109A (ankaŭ konata kiel HCAR2), membro de la subfamilio de hidrokarboksilacido GPCR esprimita en grashistoj (blankaj kaj brunaj) (Tunaru et al., 2003), kaj en imunĉeloj (Ahmed et al., 2009). ?OHB estas la nura konata endogena Peranto de GPR109A-receptoro (EC50 ~770 µM) aktivigita per d-?OHB, l-?OHB, kaj butirato, sed ne AcAc (Taggart et al., 2005). La alta koncentriĝa sojlo por aktivigo de GPR109A estas atingita per aliĝo al ketogena dieto, malsato aŭ dum ketoacidozo, kondukante al inhibicio de grashista lipolizo. La kontraŭ-lipolita efiko de GPR109A daŭrigas per inhibicio de adenylyl cyclase kaj malpliigita cAMP, malhelpante hormono-senteman trigliceridan lipazon (Ahmed et al., 2009; Tunaru et al., 2003). Tio kreas negativan religon en kiu ketozo metas modulan bremson sur ketogenezo malpliigante la liberigon de ne-esterigitaj grasacidoj de adipocitoj (Ahmed et al., 2009; Taggart et al., 2005), efiko kiu povas esti kontraŭpezita per la simpatia impulso, kiu stimulas lipolizon. Niacino (vitamino B3, nikotina acido) estas potenca (EC50 ~ 0.1 µM) Peranto por GRP109A, efike uzata dum jardekoj por dislipidemioj (Benyo et al., 2005; Benyo et al., 2006; Fabbrini et al., 2010a; Lukasova). et al., 2011; Tunaru et al., 2003). Dum niacino plibonigas inversan kolesterolan transporton en makrofagoj kaj reduktas aterosklerotajn lezojn (Lukasova et al., 2011), la efikoj de ?OHB sur aterosklerozaj lezoj restas nekonataj. Kvankam GPR109A-receptoro praktikas protektajn rolojn, kaj interesaj ligoj ekzistas inter ketogena dieto-uzo en apopleksio kaj neŭrodegeneraj malsanoj (Fu et al., 2015; Rahman et al., 2014), protekta rolo de ?OHB per GPR109A ne estis pruvita en vivo. .
Fine, ?OHB povas influi apetiton kaj satecon. Metaanalizo de studoj, kiuj mezuris la efikojn de ketogenaj kaj tre malaltaj energiaj dietoj konkludis, ke partoprenantoj konsumantaj ĉi tiujn dietojn montras pli altan satecon, kompare kun kontrolaj dietoj (Gibson et al., 2015). Tamen, kredinda klarigo por ĉi tiu efiko estas la pliaj metabolaj aŭ hormonaj elementoj, kiuj povus moduli apetiton. Ekzemple, musoj konservitaj sur ronĝula ketogena dieto elmontris pliigitan energi-elspezon kompare al musoj nutritaj kun kontrolo de manĝo, malgraŭ simila kaloria konsumo, kaj cirkulanta leptino aŭ genoj de peptidoj reguligantaj manĝadkonduton ne estis ŝanĝitaj (Kennedy et al., 2007). Inter proponitaj mekanismoj kiuj sugestas apetitsubpremadon de ?OHB inkluzivas kaj signaladon kaj oksigenadon (Laeger et al., 2010). Specifa forigo de hepatocitoj de cirkadia ritmo geno (Per2) kaj kromatina imunoprecipitado-studoj malkaŝis, ke PER2 rekte aktivigas la genon Cpt1a, kaj nerekte reguligas Hmgcs2, kondukante al difektita ketozo en Per2 knokaŭtaj musoj (Chavan et al., 2016). Tiuj musoj elmontris difektitan manĝan antaŭvidon, kiu estis parte restarigita per ĉiea ?OHB-administrado. Estontaj studoj estos necesaj por konfirmi la centran nervan sistemon kiel rektan ?OHB-celon, kaj ĉu ketonoksidado estas postulata por la observitaj efikoj, aŭ ĉu alia signala mekanismo estas implikita. Aliaj esploristoj alvokis la eblecon de loka astrocit-derivita ketogenezo ene de la ventromediala hipotalamo kiel reguliganto de manĝaĵo, sed ĉi tiuj preparaj observoj ankaŭ profitos el genetikaj kaj fluo-bazitaj taksoj (Le Foll et al., 2014). La rilato inter ketozo kaj nutra senigo restas interesa ĉar malsato kaj sateco estas gravaj elementoj en malsukcesaj provoj de malplipeziĝo.
Integriĝo de Ketona Korpo Metabolo, Post-Traduka Modifo kaj Ĉela Fiziologio
Ketonaj korpoj kontribuas al kompartimentitaj naĝejoj de acetil-CoA, ŝlosila interaĵo kiu elmontras elstarajn rolojn en ĉela metabolo (Pietrocola et al., 2015). Unu rolo de acetil-CoA estas servi kiel substrato por acetiligo, enzime katalizita histona kovalenta modifo (Choudhary et al., 2014; Dutta et al., 2016; Fan et al., 2015; Menzies et al., 2016; ). Granda nombro da dinamike acetilitaj mitokondriaj proteinoj, multaj el kiuj povas okazi per ne-enzimaj mekanismoj, ankaŭ eliris el komputilaj proteomikaj studoj (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013). ; Shimazu et al., 2010). Lizindeacetilazoj uzas zinkan kofaktoron (ekz., nucleocytosolic HDACs) aŭ NAD+ kiel kunsubstrato (sirtuins, SIRTs) (Choudhary et al., 2014; Menzies et al., 2016). La acetilproteomo funkcias kiel kaj sensilo kaj efikilo de la totala ĉela acetil-CoA naĝejo, ĉar fiziologiaj kaj genetikaj manipuladoj ĉiu rezultigas ne-enzimajn tutmondajn variojn de acetilado (Weinert et al., 2014). Ĉar intraĉelaj metabolitoj funkcias kiel modulatoroj de lizinrestaĵacetiligo, estas grave konsideri la rolon de ketonkorpoj, kies abundo estas tre dinamika.
?OHB estas epigenetika modifilo per almenaŭ du mekanismoj. Pliigitaj ?OHB-niveloj induktitaj per fastado, kaloria limigo, rekta administrado aŭ longedaŭra ekzercado provokas HDAC-inhibicion aŭ histon-acetiltransferazaktivigon (Marosi et al., 2016; Sleiman et al., 2016) aŭ al oksidativa streso (Shimazu et al., 2013) . ?OHB-inhibo de HDAC3 povus reguligi novnaskitan metabolan fiziologion (Rando et al., 2016). Sendepende, ?OHB mem rekte modifas histonajn lizinajn restaĵojn (Xie et al., 2016). Longdaŭra fastado, aŭ steptozotocin-induktita diabeta ketoacidozo pliigis histonan ?-hidroksibutiriladon. Kvankam la nombro da lizino-a-hidroksibutiriligo kaj acetiligo estis komparebla, stoĥiometrie pli granda histona ß-hidroksibutiriligo ol acetilado estis observita. Distingaj genoj estis trafitaj per histonlizino ?-hidroksibutiriligo, kontraŭ acetilado aŭ metiligo, sugestante apartajn ĉelajn funkciojn. Ĉu ?-hidroksibutiriligo estas spontanea aŭ enzimeca ne estas konata, sed vastigas la gamon da mekanismoj tra ketonkorpoj dinamike influas transskribon.
Esencaj ĉelaj reprogramadaj eventoj dum kaloria limigo kaj nutra senigo povas esti mediataj en SIRT3- kaj SIRT5-dependa mitokondria deacetilado kaj desuccinilation, respektive, reguligante ketogenajn kaj ketolizajn proteinojn ĉe post-traduka nivelo en hepataj kaj eksterhepataj histoj (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). Kvankam stoiĥiometria komparo de okupataj lokoj ne nepre ligas rekte al ŝanĝoj en metabola fluo, mitokondria acetiligo estas dinamika kaj povas esti pelita de acetil-CoA-koncentriĝo aŭ mitokondria pH, prefere ol enzimecaj acetiltransferazoj (Wagner kaj Payne, 2013). Ke SIRT3 kaj SIRT5 modulas agadojn de ketonkorpaj metaboligantaj enzimoj provokas la demandon pri la reciproka rolo de ketonoj en skulptado de la acetilproteomo, succinylproteome, kaj aliaj dinamikaj ĉelaj celoj. Efektive, ĉar varioj de ketogenezo reflektas NAD+-koncentriĝojn, ketonproduktado kaj abundo povus reguligi sirtuinagadon, tiel influante totalajn acetil-CoA/succinyl-CoA naĝejojn, la acilproteomon, kaj tiel mitokondrian kaj ĉelan fiziologion. ?-hidroksibutiriligo de enzimaj lizinrestaĵoj povus aldoni alian tavolon al ĉela reprogramado. En eksterhepataj histoj, ketonkorpa oksigenado povas stimuli analogajn ŝanĝojn en ĉelhomeostazo. Dum sekcio de acetil-CoA-naĝejoj estas tre reguligita kaj kunordigas larĝan spektron de ĉelaj ŝanĝoj, la kapablo de ketonaj korpoj rekte formi kaj mitokondriajn kaj citoplasmajn acetil-CoA-koncentriĝojn postulas klarigon (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen kaj Thompson, 2012). Ĉar acetil-CoA-koncentriĝoj estas malloze reguligitaj, kaj acetil-CoA estas membran impermeable, estas grave konsideri la ŝoformekanismojn kunordigantajn acetil-CoA-homeostazon, inkluzive de la indicoj de produktado kaj fina oksigenado en la TCA-ciklo, konvertiĝo en ketonkorpojn, mitokondriajn. elfluo per karnitina acetiltransferazo (CrAT), aŭ acetil-CoA eksporto al citosolo post konvertiĝo al citrato kaj liberigo de ATP-citrato liazo (ACLY). La ŝlosilaj roloj de ĉi tiuj lastaj mekanismoj en ĉela acetilproteomo kaj homeostazo postulas kongruan komprenon de la roloj de ketogenezo kaj ketonoksidado (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen kaj Thompson, 2012). Konverĝaj teknologioj en metabolomics kaj acilproteomics en la fikso de genetike manipulitaj modeloj estos postulataj por precizigi celojn kaj rezultojn.
Kontraŭ- kaj Por-Inflamaj Respondoj al Ketonaj Korpoj
Ketozo kaj ketonaj korpoj modulas inflamon kaj imunĉelan funkcion, sed diversaj kaj eĉ malkongruaj mekanismoj estis proponitaj. Longdaŭra nutra senigo reduktas inflamon (Youm et al., 2015), sed la kronika ketozo de tipo 1 diabeto estas porinflama stato (Jain et al., 2002; Kanikarla-Marie kaj Jain, 2015; Kurepa et al., 2012). ). Mekanismo-bazitaj signalaj roloj por ?OHB en inflamo aperas ĉar multaj imunsistemaj ĉeloj, inkluzive de makrofagoj aŭ monocitoj, abunde esprimas GPR109A. Dum ?OHB praktikas ĉefe kontraŭinflaman respondon (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), altaj koncentriĝoj de ketonaj korpoj, precipe AcAc, povas deĉenigi porinflaman respondon (Jain et al., 2002; Kanikarla-Marie kaj Jain, 2015; Kurepa et al., 2012).
Kontraŭinflamaj roloj de GPR109A-ligandoj en aterosklerozo, obezeco, inflama intestmalsano, neŭrologia malsano kaj kancero estis reviziitaj (Graff et al., 2016). GPR109A-esprimo estas pliigita en RPE-ĉeloj de diabetaj modeloj, homaj diabetaj pacientoj (Gambhir et al., 2012), kaj en mikroglia dum neŭrodegenero (Fu et al., 2014). Kontraŭinflamaj efikoj de ?OHB estas plifortigitaj per GPR109A-troesprimo en RPE-ĉeloj, kaj nuligitaj per farmakologia inhibicio aŭ genetika knokaŭto de GPR109A (Gambhir et al., 2012). ?OHB kaj eksogena nikotina acido (Taggart et al., 2005), ambaŭ donas kontraŭinflamatoriajn efikojn en TNF? aŭ LPS-induktita inflamo malpliigante la nivelojn de porinflamaj proteinoj (iNOS, COX-2), aŭ kaŝitaj citokinoj (TNF?, IL-1?, IL-6, CCL2/MCP-1), delvis per inhibicio de NF. -?B-translokigo (Fu et al., 2014; Gambhir et al., 2012). ?OHB malpliigas ER-streson kaj la NLRP3-inflamsomon, aktivigante la kontraŭoksidan streĉan respondon (Bae et al., 2016; Youm et al., 2015). Tamen, en neŭrodegenera inflamo, GPR109A-dependa ?OHB-mediata protekto ne implikas inflamajn mediaciistojn kiel MAPK-vojsignalado (ekz., ERK, JNK, p38) (Fu et al., 2014), sed povas postuli COX-1-dependan PGD2. produktado (Rahman et al., 2014). Estas intrige, ke makrofago GPR109A estas postulata por peni neŭroprotektan efikon en iskemia batomodelo (Rahman et al., 2014), sed la kapablo de ?OHB malhelpi la NLRP3-inflamsomon en osta medolo derivitaj makrofagoj estas GPR109A sendependa (Youm et al., 2015). ., 2014). Kvankam plej multaj studoj ligas ?OHB al kontraŭinflamaj efikoj, ?OHB povas esti proinflama kaj pliigi markilojn de lipida peroksidado en bovidaj hepatocitoj (Shi et al., XNUMX). Kontraŭ-kontraŭ por-inflamaj efikoj de ?OHB povas tiel dependi de ĉeltipo, ?OHB-koncentriĝo, ekspondaŭro, kaj la ĉeesto aŭ foresto de ko-moduliloj.
Male al ?OHB, AcAc povas aktivigi porinflaman signaladon. Levita AcAc, precipe kun alta glukozokoncentriĝo, intensigas endoteliajn ĉelvundojn per NADPH-oksidazo/oksidativa streĉa dependa mekanismo (Kanikarla-Marie kaj Jain, 2015). Altaj AcAc-koncentriĝoj en umbilika ŝnuro de diabetaj patrinoj estis korelaciitaj kun pli alta proteina oksidiĝa indico kaj MCP-1-koncentriĝo (Kurepa et al., 2012). Alta AcAc en diabetaj pacientoj estis korelaciita kun TNF? esprimo (Jain et al., 2002), kaj AcAc, sed ne ?OHB, induktis TNF?, MCP-1-esprimon, ROS-amasiĝon, kaj malpliigitan cAMP-nivelon en homaj monocitĉeloj U937 (Jain et al., 2002; Kurepa et al. ., 2012).
Ketonkorpaj dependaj signalaj fenomenoj estas ofte ekigitaj nur kun altaj ketonkorpaj koncentriĝoj (> 5 mM), kaj en la kazo de multaj studoj ligantaj ketonojn al por- aŭ kontraŭinflamaj efikoj, per neklaraj mekanismoj. Krome, pro la kontraŭdiraj efikoj de ?OHB kontraŭ AcAc sur inflamo, kaj la kapablo de AcAc/?OHB-proporcio influi mitokondrian redox-potencialon, la plej bonaj eksperimentoj taksantaj la rolojn de ketonkorpoj sur ĉelaj fenotipoj komparas la efikojn de AcAc kaj ? OHB en diversaj proporcioj, kaj ĉe diversaj akumulaj koncentriĝoj [ekz., (Saito et al., 2016)]. Finfine, AcAc povas esti aĉetita komerce nur kiel litia salo aŭ kiel etilester kiu postulas bazhidrolizon antaŭ uzo. Litia katjono sendepende induktas signalajn transduktajn kaskadojn (Manji et al., 1995), kaj AcAc-anjono estas labila. Finfine, studoj uzantaj raceman d/l-?OHB povas esti konfuzitaj, ĉar nur la d-?OHB-stereoizomero povas esti oksigenita al AcAc, sed d-?OHB kaj l-?OHB povas ĉiu signali tra GPR109A, malhelpi la NLRP3-inflamsomon, kaj servas kiel lipogenaj substratoj.
Ketonaj Korpoj, Oksidativa Streso kaj Neŭroprotekto
Oksidativa streso estas tipe difinita kiel stato en kiu ROS estas prezentitaj en troo, pro troa produktado kaj/aŭ difektita elimino. Antioksida kaj oksidativa streso mildigaj roloj de ketonkorpoj estis vaste priskribitaj kaj en vitro kaj en vivo, precipe en la kunteksto de neŭroprotekto. Ĉar la plej multaj neŭronoj ne efike generas alt-energiajn fosfatojn el grasacidoj sed ja oksigenas ketonajn korpojn kiam karbonhidratoj mankas, neŭroprotektaj efikoj de ketonaj korpoj estas precipe gravaj (Cahill GF Jr, 2006; Edmond et al., 1987; Yang et al. al., 1987). En oksidativaj stresmodeloj, BDH1-indukto kaj SCOT-subpremado sugestas, ke ketonkorpa metabolo povas esti reprogramita por subteni diversajn ĉelsignalojn, redox-potencialon aŭ metabolajn postulojn (Nagao et al., 2016; Tieu et al., 2003).
Ketonaj korpoj malpliigas la gradojn de ĉela damaĝo, vundo, morto kaj pli malalta apoptozo en neŭronoj kaj kardiomiocitoj (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). Alvokitaj mekanismoj estas diversaj kaj ne ĉiam linie rilataj al koncentriĝo. Malaltaj milimolaraj koncentriĝoj de (d aŭ l) -?OHB forkaptas ROS (hidroksila anjono), dum AcAc forkaptas multajn ROS-specojn, sed nur ĉe koncentriĝoj kiuj superas la fiziologian intervalon (IC50 20-67 mM) (Haces et al., 2008) . Inverse, utila influo al la redoksa potencialo de la elektrona transportĉeno estas mekanismo ofte ligita al d-?OHB. Dum ĉiuj tri cetonaj korpoj (d/l-?OHB kaj AcAc) reduktis neŭronan ĉelmorton kaj ROS-amasiĝon ekigitan de kemia inhibicio de glikolizo, nur d-?OHB kaj AcAc malhelpis neŭronan ATP-malkreskon. Male, en hipoglikemia en vivo modelo, (d aŭ l)-?OHB, sed ne AcAc malhelpis hipokampan lipidan peroksidadon (Haces et al., 2008; Maalouf et al., 2007; Marosi et al., 2016; Murphy, 2009; ; Tieu et al., 2003). En vivaj studoj de musoj nutritaj kun ketogena dieto (87% kcal graso kaj 13% proteino) elmontris neŭroanatomian varion de antioksida kapacito (Ziegler et al., 2003), kie la plej profundaj ŝanĝoj estis observitaj en hipokampo, kun pliigo de glutationperoksidazo kaj totalo. antioksidantaj kapabloj.
Ketogena dieto, ketonaj esteroj (ankaŭ vidu Terapia uzo de ketogena dieto kaj eksogenaj ketonaj korpoj), aŭ ?OHB-administrado praktikas neŭroprotekton en modeloj de iskemia bato (Rahman et al., 2014); Parkinson-malsano (Tieu et al., 2003); oksigena tokseco de la centra nervosistemo (D'Agostino et al., 2013); epilepsiaj spasmoj (Yum et al., 2015); mitokondria encefalomiopatio, lakta acidozo kaj epizoda sindromo (MELAS) (Frey et al., 2016) kaj Alzheimer-malsano (Cunnane kaj Crawford, 2003; Yin et al., 2016). Male, lastatempa raporto pruvis histopatologian evidentecon de neŭrodegenera progresado per ketogena dieto en transgena musmodelo de eksternorma mitokondria DNA-riparo, malgraŭ pliiĝoj en mitokondria biogenezo kaj antioksidantaj subskriboj (Lauritzen et al., 2016). Aliaj konfliktantaj raportoj indikas ke eksponiĝo al altaj ketonkorpaj koncentriĝoj ellogas oksidativan streson. Altaj ?OHB aŭ AcAc-dozoj induktis nitroksidan sekrecion, lipidan peroksidadon, reduktitan esprimon de SOD, glutationperoksidazon kaj katalazon en bovidaj hepatocitoj, dum en rataj hepatocitoj la MAPK-vojindukto estis atribuita al AcAc sed ne ?OHB (Abdelmegeed et al., 2004). ; Shi et al., 2014; Shi et al., 2016).
Kunigitaj, la plej multaj raportoj ligas ?OHB al malfortiĝo de oksidativa streso, ĉar ĝia administrado malhelpas ROS/superoksidan produktadon, malhelpas lipidan peroksidadon kaj protein-oksidadon, pliigas antioksidajn proteinnivelojn kaj plibonigas mitokondrian spiradon kaj ATP-produktadon (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie kaj Jain, 2015; Maalouf et al., 2007; Maalouf kaj Rho, 2008; Marosi et al., 2016; Tieu et al., 2003; Yin et al., 2016; Ziegler et al., 2003). Dum AcAc estis pli rekte korelaciita ol ?OHB kun la indukto de oksidativa streso, ĉi tiuj efikoj ne ĉiam estas facile dissekciataj de eventualaj porinflamaj respondoj (Jain et al., 2002; Kanikarla-Marie kaj Jain, 2015; Kanikarla-Marie kaj Jain, 2016). Plie, estas kritike konsideri, ke la ŝajna antioksidativa avantaĝo donita de pleiotropaj ketogenaj dietoj eble ne estas transdukita de ketonaj korpoj mem, kaj neŭroprotekto donita de ketonaj korpoj eble ne estas tute atribuebla al oksidativa streso. Ekzemple dum senigo de glukozo, en modelo de senigo de glukozo en kortikalaj neŭronoj, ?OHB stimulis aŭtofagian fluon kaj malhelpis amasiĝon de aŭtofagosoma, kiu estis asociita kun malpliigita neŭrona morto (Camberos-Luna et al., 2016). d-?OHB induktas ankaŭ la kanonajn antioksidajn proteinojn FOXO3a, SOD, MnSOD kaj katalazo, eventuale per HDAC-inhibo (Nagao et al., 2016; Shimazu et al., 2013).
Ne-Alkohola Grasa Hepata Malsano (NAFLD) kaj Ketona Korpa Metabolo
Obezeco-rilata NAFLD kaj nealkohola steatohepatito (NASH) estas la plej oftaj kaŭzoj de hepatmalsano en okcidentaj landoj (Rinella kaj Sanyal, 2016), kaj NASH-induktita hepatmalsukceso estas unu el la plej oftaj kialoj de hepattransplantado. Dum troa stokado de triacilgliceroloj en hepatocitoj>5% de hepata pezo (NAFL) sole ne kaŭzas degeneran hepatan funkcion, la progresado al NAFLD en homoj korelacias kun ĉiea insulinrezisto kaj pliigita risko de tipo 2 diabeto, kaj povas kontribui al la patogenezo de. kardiovaskula malsano kaj kronika rena malsano (Fabbrini et al., 2009; Targher et al., 2010; Targher kaj Byrne, 2013). La patogenaj mekanismoj de NAFLD kaj NASH estas nekomplete komprenitaj sed inkluzivas anomaliojn de hepatocita metabolo, hepatocita aŭtofagio kaj endoplasma retikulstreso, hepata imunĉela funkcio, adipoza histo inflamo kaj ĉieaj inflamaj mediaciistoj (Fabbrini et al., 2009; Masuoka kaj Chalasani, 2013). ; Targher et al., 2010; Yang et al., 2010). Perturboj de karbonhidrato, lipido, kaj aminoacida metabolo okazas en kaj kontribuas al obezeco, diabeto kaj NAFLD en homoj kaj en modelaj organismoj [reviziita en (Farese et al., 2012; Lin kaj Accili, 2011; Newgard, 2012; Samuel kaj Shulman, 2012; Suno kaj Lazaro, 2013). Dum hepatocitaj anomalioj en citoplasma lipida metabolo estas ofte observitaj en NAFLD (Fabbrini et al., 2010b), la rolo de mitokondria metabolo, kiu regas oksidativan forigon de grasoj estas malpli klara en NAFLD-patogenezo. Anomalioj de mitokondria metabolo okazas kaj kontribuas al NAFLD/NASH-patogenezo (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). Estas ĝenerala (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) sed ne unuforma ( Koliaki kaj Roden, 2013; Perry et al., 2016; Rector et al., 2010) konsentas ke, antaŭ la evoluo de bona fide NASH, hepata mitokondria oksigenado, kaj precipe grasoksigenado, estas pliigita en obezeco, ĉiea insulinrezisto. , kaj NAFLD. Estas verŝajne ke dum NAFLD progresas, oksidativa kapacita heterogeneco, eĉ inter individuaj mitokondrioj, aperas, kaj finfine oksidativa funkcio iĝas difektita (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al., 2012; ., XNUMX).
Ketogenezo ofte estas utiligita kiel anstataŭanto por hepata grasoksigenado. Kripliĝoj de ketogenezo aperas kiam NAFLD progresas en bestaj modeloj, kaj verŝajne en homoj. Per nekomplete difinitaj mekanismoj, hiperinsulinemio subpremas ketogenezon, eble kontribuante al hipoketonemio kompare kun malgrasaj kontroloj (Bergman et al., 2007; Bickerton et al., 2008; Satapati et al., 2012; Soeters et al., 2009; Sunny et al., 2011; , 2005; Vice et al., 2015). Tamen, la kapablo de cirkulantaj ketonkorpaj koncentriĝoj antaŭdiri NAFLD estas kontestata (Männistö et al., 2001; Sanyal et al., 2012). Fortikaj kvantaj magnetresonancaj spektroskopaj metodoj en bestaj modeloj malkaŝis pliigitan ketonan turnoprocenton kun modera insulina rezisto, sed malpliigitaj indicoj estis evidentaj kun pli severa insulinrezisto (Satapati et al., 2010; Sunny et al., 2008). En obezaj homoj kun grashepato, ketogena indico estas normala (Bickerton et al., 2011; Sunny et al., 4), kaj tial, la indicoj de ketogenezo estas malpliigitaj relative al la pliigita grasacida ŝarĝo ene de hepatocitoj. Sekve, ?-oksidiĝ-derivita acetil-CoA povas esti direktita al fina oksigenado en la TCA-ciklo, pliigante fina oksigenadon, fosfoenolpiruvat-movitan glukoneogenezon per anaplerozo/kataplerozo, kaj oksidativa streso. Acetil-CoA ankaŭ eble spertas eksportadon de mitokondrioj kiel citrato, antaŭsubstrato por lipogenezo (Fig. 2015) (Satapati et al., 2012; Satapati et al., 2015; Solinas et al., 2012). Dum ketogenezo fariĝas malpli respondema al insulino aŭ fastado kun longedaŭra obezeco (Satapati et al., 1), la subestaj mekanismoj kaj kontraŭfluaj sekvoj de ĉi tio restas nekomplete komprenitaj. Lastatempa indico indikas, ke mTORC2016 subpremas ketogenezon en maniero kiu povas esti laŭflue de insulina signalado (Kucejova et al., 1), kio kongruas kun la observoj, ke mTORC2 malhelpas Hmgcs2010-indukton de PPAR? (Sengupta et al., 2) ( ankaŭ vidu Reguligon de HMGCS1 kaj SCOT/OXCTXNUMX).

Antaŭaj observoj de nia grupo sugestas malfavorajn hepatajn konsekvencojn de ketogena nesufiĉo (Cotter et al., 2014). Por testi la hipotezon, ke difektita ketogenezo, eĉ en karbonhidrat-plenaj kaj tiel "ne-ketogenaj" ŝtatoj, kontribuas al nenormala glukoza metabolo kaj provokas steatohepatiton, ni generis musan modelon de konsiderinda ketogena nesufiĉo per administrado de kontraŭsensaj oligonukleotidoj (ASO) celita al. Hmgcs2. Perdo de HMGCS2 en normaj malaltgrasaj manĝaĵaj plenkreskaj musoj kaŭzis mildan hiperglikemion kaj rimarkinde pliigis produktadon de centoj da hepataj metabolitoj, aro de kiuj forte sugestis lipogenezaktivigon. Alt-grasa dieta nutrado de musoj kun nesufiĉa ketogenezo rezultigis ampleksan hepatocitan vundon kaj inflamon. Ĉi tiuj trovoj subtenas la centrajn hipotezojn ke (i) ketogenezo ne estas pasiva superflua vojo sed prefere dinamika nodo en hepata kaj integra fiziologia homeostazo, kaj (ii) prudenta ketogena pliigo por mildigi NAFLD/NASH kaj malorda hepata glukozometabolo estas inda je esplorado. .
Kiel difektita ketogenezo povus kontribui al hepata vundo kaj ŝanĝita glukoza homeostazo? La unua konsidero estas ĉu la kulpulo estas manko de ketogena fluo, aŭ ketonoj mem. Freŝa raporto sugestas, ke ketonaj korpoj povas mildigi oksidativan stres-induktitan hepatan vundon en respondo al n-3 polinesaturitaj grasacidoj (Pawlak et al., 2015). Memoru, ke pro manko de SCOT-esprimo en hepatocitoj, ketonkorpoj ne estas oksigenitaj, sed ili povas kontribui al lipogenezo, kaj servi diversajn signalajn rolojn sendependaj de ilia oksigenado (ankaŭ vidu Neoksidativaj metabolaj sortoj de ketonkorpoj kaj ?OHB kiel? signalanta peranto). Estas ankaŭ eble ke hepatocit-derivitaj ketonkorpoj povas funkcii kiel signalo kaj/aŭ metabolito por najbaraj ĉeltipoj ene de la hepata acino, inkluzive de stelitaj ĉeloj kaj Kupffer-ĉelmacrófagoj. Dum la limigita literaturo havebla indikas ke makrofagoj estas nekapablaj oksigeni ketonkorpojn, tio estis nur mezurita uzante klasikajn metodarojn, kaj nur en peritoneaj makrofagoj (Newsholme et al., 1986; Newsholme et al., 1987), indikante ke re- taksado taŭgas pro abunda SCOT-esprimo en osta medolo-derivita makrofagoj (Youm et al., 2015).
Hepatocita ketogena fluo ankaŭ povas esti citoprotekta. Dum sanaj mekanismoj eble ne dependas de ketogenezo en si mem, malaltaj karbonhidrataj ketogenaj dietoj estis asociitaj kun plibonigo de NAFLD (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar kaj Crawford, 2012) . Niaj observoj indikas, ke hepatocita ketogenezo povas retrosciigi kaj reguligi TCA-ciklan fluon, anaplerotan fluon, fosfoenolpiruvat-derivitan glukonogenezon (Cotter et al., 2014), kaj eĉ glikogenan spezon. Ketogena difekto direktas acetil-CoA por pliigi TCA-fluon, kiu en hepato estis ligita al pliigita ROS-mediaciita vundo (Satapati et al., 2015; Satapati et al., 2012); devigas deturniĝon de karbono en de novo sintezitajn lipidspeciojn kiuj povis pruvi citotoksaj; kaj malhelpas NADH-re-oksidadon al NAD+ (Cotter et al., 2014) (Fig. 4). Kunigitaj, estontaj eksperimentoj estas postulataj por trakti mekanismojn per kiuj relativa ketogena nesufiĉo povas iĝi misadapta, kontribui al hiperglikemio, provoki steatohepatiton, kaj ĉu ĉi tiuj mekanismoj funkcias en homa NAFLD/NASH. Ĉar epidemiologia indico sugestas difektitan ketogenezon dum la progresado de steatohepatito (Embade et al., 2016; Marinou et al., 2011; Männistö et al., 2015; Pramfalk et al., 2015; Safaei et al., 2016) terapioj kiuj pliigas hepata ketogenezo povus pruvi sana (Degirolamo et al., 2016; Honda et al., 2016).
Ketonaj korpoj kaj korinsuficienco (HF)
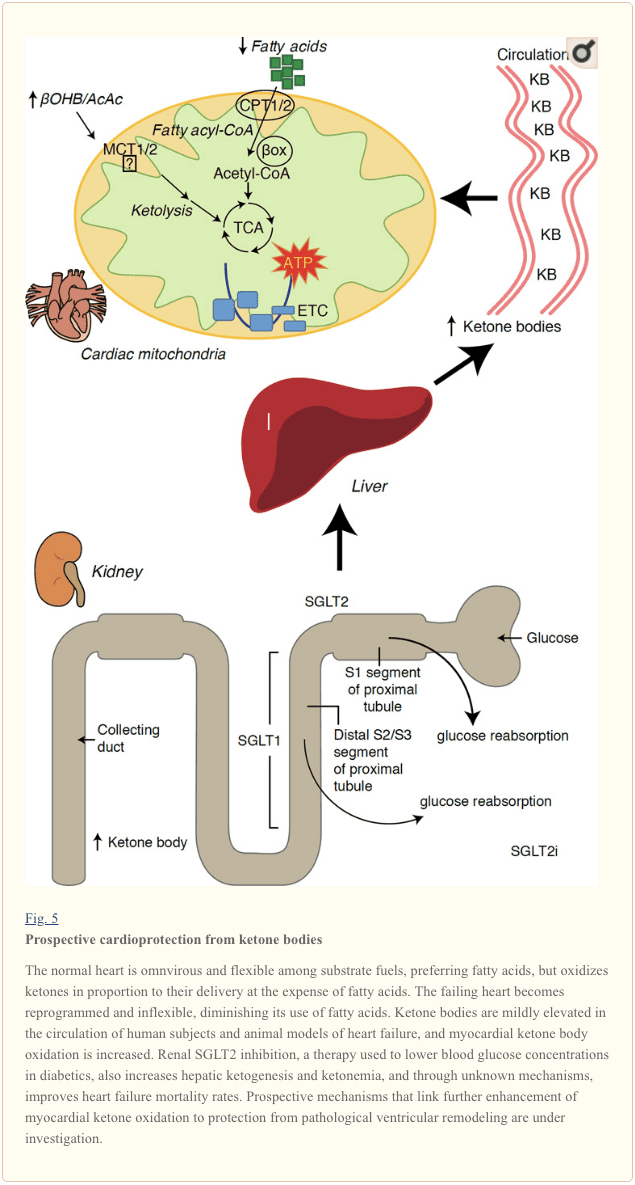
Kun metabola rapideco superanta 400 kcal/kg/tage, kaj spezo de 6-35 kg ATP/tage, la koro estas la organo kun la plej alta energielspezo kaj oksidativa postulo (Ashrafian et al., 2007; Wang et al., 2010b). La vasta plimulto de miokardia energispezo loĝas ene de mitokondrioj, kaj 70% de tiu provizo originas de FAO. La koro estas ĉiomanĝa kaj fleksebla en normalaj kondiĉoj, sed la patologie restrukturanta koro (ekz., pro hipertensio aŭ miokardia infarkto) kaj la diabeta koro ĉiu iĝas metabola nefleksebla (Balasse kaj Fery, 1989; BING, 1954; Fukao et al., 2004). ; Lopaschuk et al., 2010; Taegtmeyer et al., 1980; Taegtmeyer et al., 2002; Young et al., 2002). Efektive, genetike programitaj anomalioj de kora fuelmetabolo en musmodeloj provokas kardiomiopation (Carley et al., 2014; Neubauer, 2007). Sub fiziologiaj kondiĉoj normalaj koroj oksigenas ketonkorpojn proporcie al sia liveraĵo, koste de grasacido kaj glukoza oksigenado, kaj miokardio estas la plej alta ketonkorpa konsumanto per unuomaso (BING, 1954; Crawford et al., 2009; GARLAND et al. ., 1962; Hasselbaink et al., 2003; Jeffrey et al., 1995; Pelletier et al., 2007; Tardif et al., 2001; Yan et al., 2009). Kompare al grasacida oksigenado, ketonkorpoj estas pli energie efikaj, donante pli da energio disponebla por ATP-sintezo per molekulo de oksigeno investita (P/O-proporcio) (Kashiwaya et al., 2010; Sato et al., 1995; Veech, 2004) . Oksigenado de cetona korpo ankaŭ donas eble pli altan energion ol FAO, tenante ubikvinonon oksigenita, kiu pliigas redox-interspacon en la elektrona transportĉeno kaj disponigas pli da energio por sintezi ATP (Sato et al., 1995; Veech, 2004). Oksigenado de ketonkorpoj ankaŭ povas limigi ROS-produktadon, kaj tiel oksidativan streson (Veech, 2004).
Antaŭaj intervenaj kaj observaj studoj indikas eblan sanan rolon de ketonaj korpoj en la koro. En la eksperimenta iskemio/reperfuza vunda kunteksto, ketonaj korpoj donis eblajn kardioprotektajn efikojn (Al-Zaid et al., 2007; Wang et al., 2008), eble pro la pliiĝo mitokondria abundo en koro aŭ suprenreguligo de decida oksidativa fosforiligo. perantoj (Snorek et al., 2012; Zou et al., 2002). Lastatempaj studoj indikas ke ketonkorpa utiligo pliiĝas en malsukcesaj koroj de musoj (Aubert et al., 2016) kaj homoj (Bedi et al., 2016), apogante antaŭajn observaĵojn en homoj (BING, 1954; Fukao et al., 2000; Janardhan et al., 2011; Longo et al., 2004; Rudolph kaj Schinz, 1973; Tildon kaj Cornblath, 1972). Cirkulaj ketonkorpaj koncentriĝoj estas pliigitaj ĉe korinsuficienco pacientoj, en rekta proporcio al plenigpremoj, observoj kies mekanismo kaj signifo restas nekonataj (Kupari et al., 1995; Lommi et al., 1996; Lommi et al., 1997; Neely et al., 1972; Neely et al. ., 2014), sed musoj kun selektema SCOT-manko en kardiomiocitoj elmontras akcelitan patologian ventriklan restrukturadon kaj ROS-signaturojn en respondo al kirurgie induktita prema troŝarĝa vundo (Schugar et al., XNUMX).
Lastatempaj interesaj observoj en diabetterapio malkaŝis eblan ligon inter miokardia ketonmetabolo kaj patologia ventrikla remodelado (Fig. 5). Inhibicio de la rena proksimala tubforma natrio/glukoza kuntransportilo 2 (SGLT2i) pliigas cirkulajn ketonkorpajn koncentriĝojn en homoj (Ferrannini et al., 2016a; Inagaki et al., 2015) kaj musoj (Suzuki et al., 2014) per pliiĝo. hepata ketogenezo (Ferrannini et al., 2014; Ferrannini et al., 2016a; Katz kaj Leiter, 2015; Mudaliar et al., 2015). Frape, almenaŭ unu el ĉi tiuj agentoj malpliigis HF-hospitaligon (ekz., kiel malkaŝite de la provo EMPA-REG OUTOME), kaj plibonigis kardiovaskulan mortecon (Fitchett et al., 2016; Sonesson et al., 2016; Wu et al., 2016a). ; Zinman et al., 2015). Dum la ŝoformekanismoj malantaŭ utilaj HF-rezultoj al ligita SGLT2i restas aktive diskutataj, la postviva profito estas verŝajne multfaktora, eventuale inkluzivanta ketozon sed ankaŭ salutajn efikojn al pezo, sangopremo, glukozo- kaj uratacida niveloj, arteria rigideco, la simpata nerva sistemo, osmoza. diurezo/reduktita plasmovolumeno, kaj pliigita hematokrito (Raz kaj Cahn, 2016; Vallon kaj Thomson, 2016). Kune, la nocio, ke terapie pliiĝanta ketonemio aŭ en HF-pacientoj, aŭ tiuj kun alta risko por disvolvi HF, restas kontestata sed estas sub aktiva esploro en antaŭ-klinikaj kaj klinikaj studoj (Ferrannini et al., 2016b; Kolwicz et al., 2016; Lopaschuk kaj Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
Ketonaj Korpoj en Kancera Biologio
Ligoj inter ketonaj korpoj kaj kancero rapide aperas, sed studoj en kaj bestaj modeloj kaj homoj donis diversajn konkludojn. Ĉar ketonmetabolo estas dinamika kaj nutra stato respondema, estas alloge trakti biologiajn ligojn al kancero pro la potencialo por precize gviditaj nutraj terapioj. Kanceraj ĉeloj spertas metabolan reprogramadon por konservi rapidan ĉelan proliferadon kaj kreskon (DeNicola kaj Cantley, 2015; Pavlova kaj Thompson, 2016). La klasika Warburg-efekto en kancerĉela metabolo ekestiĝas de la domina rolo de glikolizo kaj laktacida fermentado por transdoni energion kaj kompensi pli malaltan dependecon de oksidativa fosforiligo kaj limigita mitokondria spirado (De Feyter et al., 2016; Grabacka et al., 2016; Kang et al., 2015; Poff et al., 2014; Shukla et al., 2014). Glukoza karbono estas ĉefe direktita per glikolizo, la pentoza fosfata vojo, kaj lipogenezo, kiuj kune provizas intermediarojn necesajn por tumora biomasa ekspansio (Grabacka et al., 2016; Shukla et al., 2014; Yoshii et al., 2015). Adapto de kanceraj ĉeloj al glukozo-senigo okazas per la kapablo ekspluati alternativajn fuelfontojn, inkluzive de acetato, glutamino kaj aspartato (Jaworski et al., 2016; Sullivan et al., 2015). Ekzemple, limigita aliro al piruvato rivelas la kapablon de kanceraj ĉeloj konverti glutaminon en acetil-CoA per karboksiligo, konservante kaj energiajn kaj anabolajn bezonojn (Yang et al., 2014). Interesa adapto de kanceraj ĉeloj estas la utiligo de acetato kiel brulaĵo (Comerford et al., 2014; Jaworski et al., 2016; Mashimo et al., 2014; Wright kaj Simone, 2016; Yoshii et al., 2015). Acetato ankaŭ estas substrato por lipogenezo, kiu estas kritika por tumorĉelmultobliĝo, kaj gajno de ĉi tiu lipogena akvokonduktilo estas rilata al pli mallonga pacienca supervivo kaj pli granda tumorŝarĝo (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al. ., 2015).
Ne-kancero-ĉeloj facile ŝanĝas sian energifonton de glukozo al ketonaj korpoj dum glukozo-senigo. Ĉi tiu plastikeco povas esti pli varia inter kanceraj ĉeltipoj, sed en vivo enplantitaj cerbaj tumoroj oksidiĝis [2,4-13C2]-?OHB al simila grado kiel ĉirkaŭa cerba histo (De Feyter et al., 2016). "Reversa Warburg-efiko" aŭ "du-kupea tumormetabolo" modeloj hipotezas ke kanceraj ĉeloj induktas ?OHB-produktadon en apudaj fibroblastoj, provizante la energibezonojn de la tumorĉelo (Bonuccelli et al., 2010; Martinez-Outschoorn et al., 2012). En hepato, ŝanĝo en hepatocitoj de ketogenezo al ketonoksidado en hepatoĉelaj karcinomaj (hepatomaj) ĉeloj estas kongrua kun aktivigo de BDH1 kaj SCOT-agadoj observitaj en du hepatomaj ĉellinioj (Zhang et al., 1989). Efektive, hepatomaj ĉeloj esprimas OXCT1 kaj BDH1 kaj oksigenas ketonojn, sed nur kiam serumo malsatas (Huang et al., 2016). Alternative, tumorĉelketogenezo ankaŭ estis proponita. Dinamikaj ŝanĝoj en ketogena genesprimo estas elmontritaj dum kancera transformo de kolonika epitelio, ĉeltipo kiu normale esprimas HMGCS2, kaj lastatempa raporto sugestis, ke HMGCS2 povas esti prognoza signo de malbona prognozo en kolorektaj kaj skvamaj ĉelaj karcinomoj (Camarero et al., 2006; Chen et al., 2016). Ĉu tiu unuiĝo postulas aŭ implikas ketogenezon, aŭ lunlumfunkcion de HMGCS2, restas por determini. Male, ŝajna ?OHB-produktado de melanomaj kaj glioblastomaj ĉeloj, stimulitaj de la PPAR? agonisto fenofibrato, estis asociita kun kreskohalto (Grabacka et al., 2016). Pliaj studoj estas postulataj por karakterizi rolojn de HMGCS2/SCOT-esprimo, ketogenezo kaj ketonoksidado en kanceraj ĉeloj.
Preter la sfero de fuelmetabolo, ketonoj ĵus estis implikitaj en kancerĉela biologio per signala mekanismo. Analizo de BRAF-V600E+ melanomo indikis OCT1-dependan indukton de HMGCL en onkogena BRAF-dependa maniero (Kang et al., 2015). HMGCL-aŭgmento estis korelaciita kun pli alta ĉela AcAc-koncentriĝo, kiu siavice plifortigis BRAFV600E-MEK1-interagon, plifortigante MEK-ERK-signaladon en furaĝ-antaŭa buklo kiu movas tumorĉelmultobliĝon kaj kreskon. Ĉi tiuj observoj levas la interesan demandon de eventuala eksterhepata ketogenezo kiu tiam apogas signalan mekanismon (ankaŭ vidu ?OHB kiel signalanta mediaciisto kaj Konfliktoj en eksterhepata ketogenezo). Estas ankaŭ grave konsideri sendependajn efikojn de AcAc, d-?OHB, kaj l-?OHB sur kancermetabolo, kaj kiam pripensante HMGCL, leŭcinkatabolo ankaŭ povas esti konfuzita.
La efikoj de ketogenaj dietoj (vidu ankaŭ Terapia uzo de ketogena dieto kaj eksogenaj ketonaj korpoj) en kanceraj bestaj modeloj estas diversaj (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al., 2014; ., 2011; Seyfried et al., 2014; Shukla et al., 2016). Dum epidemiologiaj asocioj inter obezeco, kancero kaj ketogenaj dietoj estas diskutitaj (Liskiewicz et al., 2016; Wright kaj Simone, 2016), metaanalizo uzanta ketogenajn dietojn en bestaj modeloj kaj en homaj studoj sugestis savan efikon al supervivo, kun profitoj eventuale ligitaj al la grandeco de ketozo, tempo de dieto-inico kaj tumoro-loko (Klement et al., 2016; Woolf et al., 81). Traktado de pankreataj kanceraj ĉeloj kun ketonkorpoj (d-?OHB aŭ AcAc) malhelpis kreskon, proliferadon kaj glikolizon, kaj ketogena dieto (18% kcal-graso, 1% proteino, 2014% karbonhidrato) reduktis en vivo tumoran pezon, glikemion, kaj pliigita muskolo kaj korpa pezo en bestoj kun enplantita kancero (Shukla et al., 2014). Similaj rezultoj estis observitaj uzante metastazan glioblastoma ĉelmodelo en musoj kiuj ricevis ketonan suplementon en la dieto (Poff et al., 91). Male, ketogena dieto (9% kcal graso, 2016% proteino) pliigis cirkulantan ?OHB-koncentriĝon kaj malpliigis glikemion sed havis neniun efikon al aŭ tumorvolumeno aŭ postvivado daŭro en gliom-portantaj ratoj (De Feyter et al., 2015). Glukoza cetona indekso estis proponita kiel klinika indikilo, kiu plibonigas metabolan administradon de ketogena dieto-induktita cerba kancero-terapio en homoj kaj musoj (Meidenbauer et al., XNUMX). Kunigitaj, roloj de cetona korpo metabolo kaj ketonaj korpoj en kancero-biologio estas tentaj ĉar ili ĉiu prezentas trakteblajn terapiajn eblojn, sed fundamentaj aspektoj restas klarigeblaj, kun klaraj influoj elirantaj el matrico de variabloj, inkluzive de (i) diferencoj inter eksogena ketono. korpoj kontraŭ ketogena dieto, (ii) kancerĉela tipo, genomaj polimorfismoj, grado kaj stadio; kaj (iii) tempo kaj daŭro de eksponiĝo al la ketoza stato.

Ketogenezo estas kreita de ketonaj korpoj tra la rompo de grasacidoj kaj ketogenaj aminoacidoj. Ĉi tiu biokemia procezo provizas energion al diversaj organoj, specife la cerbo, en cirkonstancoj de fastado kiel respondo al nehavebleco de sanga glukozo. Ketonaj korpoj estas plejparte produktitaj en la mitokondrioj de hepataj ĉeloj. Dum aliaj ĉeloj kapablas efektivigi ketogenezon, ili ne estas tiel efikaj kiel hepataj ĉeloj. Ĉar ketogenezo okazas en la mitokondrioj, ĝiaj procezoj estas reguligitaj sendepende.
D-ro Alex Jimenez DC, CCST Insight
Terapia Apliko de Ketogena Dieto kaj Eksogenaj Ketonaj Korpoj
La aplikoj de ketogenaj dietoj kaj ketonaj korpoj kiel terapiaj iloj ankaŭ ekestis en ne-kancaj kuntekstoj inkluzive de obezeco kaj NAFLD/NASH (Browning et al., 2011; Foster et al., 2010; Schugar kaj Crawford, 2012); korinsuficienco (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); neŭrologia kaj neŭrodegenera malsano (Martin et al., 2016; McNally kaj Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang kaj Cheng, 2010; Yao et al., 2011); denaskaj eraroj de metabolo (Scholl-Bürgi et al, 2015); kaj ekzerca agado (Cox et al., 2016). La efikeco de ketogenaj dietoj estis precipe aprezita en terapio de epilepsia krizo, precipe en medikament-rezistemaj pacientoj. Plej multaj studoj taksis ketogenajn dietojn en infanaj pacientoj, kaj malkaŝas ĝis ~50% redukton en ofteco de epilepsioj post 3 monatoj, kun plibonigita efikeco en elektitaj sindromoj (Wu et al., 2016b). La sperto estas pli limigita en plenkreska epilepsio, sed simila redukto estas evidenta, kun pli bona respondo en simptomaj ĝeneraligitaj epilepsiaj pacientoj (Nei et al., 2014). Subestaj kontraŭ-konvulsiaj mekanismoj restas neklaraj, kvankam postulitaj hipotezoj inkluzivas reduktitan glukozo-utiligon/glikolizon, reprogramitan glutamattransporton, nerektan efikon al ATP-sentema kaliokanalo aŭ adenozina A1-receptoro, ŝanĝo de natria kanala izoforma esprimo aŭ efikoj al cirkulantaj hormonoj inkluzive de leptino. Lambrechts et al., 2016; Lin et al., 2017; Lutas kaj Yellen, 2013). Restas neklare ĉu la kontraŭkonvulsiva efiko estas ĉefe atribuebla al ketonaj korpoj, aŭ pro la kaskadaj metabolaj sekvoj de malaltaj karbonhidrataj dietoj. Tamen, ketonesteroj (vidu malsupre) ŝajnas altigi la forkaptan sojlon en bestaj modeloj de provokitaj atakoj (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
Atkins-stilaj kaj ketogenaj, malaltaj karbonhidrataj dietoj ofte estas rigardataj malagrablaj, kaj povas kaŭzi estreñimiento, hiperuricemion, hipokalcemion, hipomagnezemion, konduki al nefrolitiazo, ketoacidozo, kaŭzi hiperglikemion kaj altigi cirkulantan kolesterolon kaj liberajn grasacidajn koncentriĝojn (Bisschop et al., 2001). ; Kossoff kaj Hartman, 2012; Kwiterovich et al., 2003; Suzuki et al., 2002). Pro ĉi tiuj kialoj, longperspektiva sekvado prezentas defiojn. Studoj pri ronĝuloj kutime uzas karakterizan distribuon de makronutraĵoj (94% kcal graso, 1% kcal karbonhidrato, 5% kcal proteino, Bio-Serv F3666), kiu provokas fortikan ketozon. Tamen, pliigi la proteinan enhavon, eĉ ĝis 10% kcal multe malpliigas la ketozon, kaj 5% kcal proteina restrikto donas konfuzajn metabolajn kaj fiziologiajn efikojn. Ĉi tiu dieta formulo ankaŭ estas malplenigita de kolino, alia variablo kiu influas malsaniĝemecon al hepata vundo, kaj eĉ ketogenezo (Garbow et al., 2011; Jornayvaz et al., 2010; Kennedy et al., 2007; Pissios et al., 2013; Schugar). et al., 2013). Efikoj de longperspektiva konsumo de ketogenaj dietoj en musoj restas nekomplete difinitaj, sed lastatempaj studoj en musoj rivelis normalan supervivon kaj la foreston de hepataj vundaj signoj ĉe musoj sur ketogenaj dietoj dum sia vivodaŭro, kvankam aminoacida metabolo, energia elspezo kaj signalado de insulino. estis rimarkeble reprogramitaj (Douris et al., 2015).
Mekanismoj pliigantaj ketozon per mekanismoj alternativaj al ketogenaj dietoj inkluzivas la uzon de ingesteblaj ketonkorpaj antaŭuloj. Administrado de eksogenaj ketonkorpoj povus krei unikan fiziologian staton ne renkontitan en normala fiziologio, ĉar cirkulantaj glukozo- kaj insulinkoncentriĝoj estas relative normalaj, dum ĉeloj eble ŝparis glukozon absorbadon kaj utiligon. Ketonaj korpoj mem havas mallongajn duonvivojn, kaj konsumado aŭ infuzaĵo de natria ?OHB-salo por atingi terapian ketozon provokas malfavoran natrian ŝarĝon. R/S-1,3-butanediol estas netoksa dialkoholo kiu estas facile oksigenita en la hepato por doni d/l-?OHB (Desrochers et al., 1992). En apartaj eksperimentaj kuntekstoj, ĉi tiu dozo estis ĉiutage administrita al musoj aŭ ratoj dum sep semajnoj, donante cirkulajn ?OHB-koncentriĝojn de ĝis 5 mM ene de 2 h de administrado, kiu estas stabila dum almenaŭ pliaj 3 h (D'). Agostino et al., 2013). Parta subpremado de manĝaĵo estis observita en ronĝuloj donitaj R/S-1,3-butanediol (Carpenter kaj Grossman, 1983). Krome, tri kemie apartaj cetona esteroj (KEs), (i) monoestero de R-1,3-butanediol kaj d-?OHB (R-3-hidroksibutil R-?OHB); (ii) gliceril-tris-?OHB; kaj (iii) R,S-1,3-butanediol-acetoacetat-diestero ankaŭ estis vaste studitaj (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; Desrochers et al., 1995a; ., 2010b; Kashiwaya et al., XNUMX). Eneca avantaĝo de la unua estas ke 2 moloj da fiziologia d-?OHB estas produktitaj per mole de KE, sekvante esterazhidrolizon en la intesto aŭ hepato. Sekureco, farmakokinetiko kaj toleremo estis plej vaste studitaj ĉe homoj ingestantaj R-3-hidroksibutil R-?OHB, ĉe dozoj ĝis 714 mg/kg, donante cirkulajn d-?OHB-koncentriĝojn ĝis 6 mM (Clarke et al., 2012a; Cox et al., 2016; Kemper et al., 2015; Shivva et al., 2016). En ronĝuloj, ĉi tiu KE malpliigas kalorian ingestaĵon kaj plasman totalan kolesterolon, stimulas brunan adipozan histon kaj plibonigas insulinreziston (Kashiwaya et al., 2010; Kemper et al., 2015; Veech, 2013). Lastatempaj trovoj indikas, ke dum ekzercado en trejnitaj atletoj, konsumado de R-3-hidroksibutil R-?OHB malpliigis skeletmuskolglikolizon kaj plasmajn laktatkoncentriĝojn, pliigis intramuskulan triacilglicerinan oksigenadon kaj konservis muskolglikogenan enhavon, eĉ kiam kunkonsumita karbonhidrato stimulis insulinsekrecion ( Cox et al., 2016). Plia disvolviĝo de ĉi tiuj interesaj rezultoj estas postulata, ĉar la plibonigo de eltenema ekzercado estis ĉefe pelita de fortika respondo al la KE en 2/8-subjektoj. Tamen, ĉi tiuj rezultoj apogas klasikajn studojn kiuj indikas preferon por ketonoksidado super aliaj substratoj (GARLAND et al., 1962; Hasselbaink et al., 2003; Stanley et al., 2003; Valente-Silva et al., 2015), inkluzive dum ekzercado, kaj ke trejnitaj atletoj povas esti pli preparitaj por uzi ketonojn (Johnson et al., 1969a; Johnson kaj Walton, 1972; Winder et al., 1974; Winder et al., 1975). Fine, la mekanismoj, kiuj povus subteni plibonigitan ekzercan agadon post egala kaloria ingestaĵo (diferencige distribuita inter makronutraĵoj) kaj egalaj oksigenaj konsumaj indicoj, restas por determinitaj.
Estonta Perspektivo
Siatempe plejparte stigmatigite kiel superflua vojo kapabla je akumulado de toksaj emisioj de grasa brulado en karbonhidrataj limigitaj ŝtatoj (la "ketotoksa" paradigmo), lastatempaj observaĵoj subtenas la nocion ke ketonkorpa metabolo servas sanajn rolojn eĉ en karbonhidrat-ŝarĝitaj ŝtatoj, malfermante "ketohormetikon". ' hipotezo. Dum la facilaj nutraj kaj farmakologiaj aliroj por manipuli ketonan metabolon igas ĝin alloga terapia celo, agreseme prezentitaj sed prudentaj eksperimentoj restas en kaj la bazaj kaj tradukaj esplorlaboratorioj. Neplenumitaj bezonoj aperis en la domajnoj de difinado de la rolo utiligi ketonmetabolon en korinsuficienco, obezeco, NAFLD/NASH, tipo 2 diabeto kaj kancero. La amplekso kaj efiko de "ne-kanonikaj" signalaj roloj de ketonaj korpoj, inkluzive de reguligo de PTM-oj, kiuj verŝajne retroiras kaj antaŭen en metabolajn kaj signalajn vojojn, postulas pli profundan esploradon. Fine, eksterhepata ketogenezo povus malfermi interesajn parakrinajn kaj aŭtokrinajn signalajn mekanismojn kaj ŝancojn influi kunmetabolismon ene de la nerva sistemo kaj tumoroj por atingi terapiajn celojn.
Dankojn
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
Piednotoj
Konklude, ketonaj korpoj estas kreitaj de la hepato por esti uzataj kiel energifonto kiam ne estas sufiĉe da glukozo facile havebla en la homa korpo. Ketogenezo okazas kiam estas malaltaj glukozoniveloj en la sango, precipe post kiam aliaj ĉelaj karbonhidrataj butikoj estis elĉerpitaj. La celo de la ĉi-supra artikolo estis diskuti la multdimensiajn rolojn de ketonaj korpoj en fuelmetabolo, signalado kaj terapio. La amplekso de niaj informoj estas limigita al kiropractikaj kaj spinaj sanaj aferoj. Por diskuti la temon, bonvolu demandi D-ron Jimenez aŭ kontakti nin ĉe 915-850-0900 .
Kuraĝita de doktoro Alex Jimenez
Referencita el: Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Plia Tema Diskuto: Akra Dorsa Doloro
Malantaŭa doloro estas unu el la plej ĝeneralaj kaŭzoj de handikapo kaj sopiritaj tagoj en la laboro tutmonde. Malantaŭa doloro atribuas al la dua plej ofta kialo por vizitoj de kuracisto, plimultita nur de supra-spiraj infektoj. Proksimume 80 procentoj de la loĝantaro spertos dorsdoloron almenaŭ unufoje dum sia vivo. La spino estas kompleksa strukturo formita de ostoj, artikoj, ligamentoj kaj muskoloj, inter aliaj molaj histoj. Vundoj kaj/aŭ plimalbonigitaj kondiĉoj, kiel ekzemple hernaj diskoj, povas eventuale konduki al simptomoj de malantaŭa doloro. Sportaj vundoj aŭ aŭtoveturejaj vundoj estas ofte la plej ofta kaŭzo de malantaŭa doloro, tamen, kelkfoje la plej simpla movado povas havi dolorajn rezultojn. Feliĉe, alternativaj traktadoj, kiel ekzemple kiropractika zorgo, povas helpi al reteni dolorecon per la uzo de verteblaj ĝustigoj kaj manlibroj, finfine pliboniganta dolorajn reliefojn.

KROME KROMA | GRAVA TEMO: Rekomendita El Paso, TX Kiropractoro?
Afiŝu Malgarantion
La informoj ĉi tie en "Multi-Dimensiaj Roloj de Ketona Korpoj en Fuel-Metabolo, Signalo kaj Terapioj" ne celas anstataŭigi unu-kontraŭ-unuan rilaton kun kvalifikita sanprofesiulo aŭ licencita kuracisto kaj ne estas medicina konsilo. Ni instigas vin fari sandecidojn bazitajn sur via esplorado kaj partnereco kun kvalifikita sanprofesiulo.
Blogaj Informoj kaj Ampleksaj Diskutoj
Nia informa amplekso estas limigita al Kiropractiko, muskoloskeleta, akupunkturo, fizikaj medikamentoj, bonfarto, kontribuanta etiologia viscerosomataj perturboj ene de klinikaj prezentoj, asociita somatoviscera refleksa klinika dinamiko, subluksaj kompleksoj, sentemaj sanproblemoj, kaj/aŭ funkciaj medicinaj artikoloj, temoj kaj diskutoj.
Ni provizas kaj prezentas klinika kunlaboro kun specialistoj el diversaj fakoj. Ĉiu specialisto estas regita de ilia profesia amplekso de praktiko kaj ilia jurisdikcio de licenco. Ni uzas funkciajn sanajn kaj bonfartajn protokolojn por trakti kaj subteni prizorgon por la vundoj aŭ malordoj de la muskoloskeleta sistemo.
Niaj filmetoj, afiŝoj, temoj, temoj kaj komprenoj kovras klinikajn aferojn, aferojn kaj temojn, kiuj rilatas al kaj rekte aŭ nerekte subtenas nian klinikan amplekson de praktiko.*
Nia oficejo prudente provis provizi subtenajn citaĵojn kaj identigis la koncernajn esplorstudojn subtenantajn niajn afiŝojn. Ni provizas kopiojn de subtenaj esploraj studoj haveblaj al reguligaj estraroj kaj publiko laŭ peto.
Ni komprenas, ke ni traktas aferojn, kiuj postulas plian klarigon pri tio, kiel ĝi povas helpi en aparta prizorgoplano aŭ traktado-protokolo; tial, por plu diskuti la temon supre, bonvolu bonvolu demandi D-ro Alex Jimenez, DC, Aŭ kontaktu nin ĉe 915-850-0900.
Ni estas ĉi tie por helpi vin kaj vian familion.
benoj
D-ro. Alex Jimenez A.D, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
retpoŝto: trejnisto@elpasofunctionalmedicine.com
Licencite kiel Doktoro pri Kiropraktiko (DC) en Teksaso & Nov-Meksiko*
Teksasa DC-Licenco # TX5807, Nov-Meksiko DC Licenco # NM-DC2182
Licencite kiel Registrita Flegistino (RN*) en Florido
Florida License RN License # RN9617241 (Kontrolo Nr. 3558029)
Kompakta Statuso: Plurŝtata Licenco: Rajtigita Praktiki en 40-ŝtatoj*
Nuntempe Matrikulita: ICHS: MSN* FNP (Programo pri Familio Flegistinisto)
D-ro Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Mia Cifereca Komerckarto


 Denove Ni Bonvenigas Vin¸
Denove Ni Bonvenigas Vin¸
